
科目:高中化学 来源:2016-2017学年吉林省高一上期初化学卷(解析版) 题型:实验题
(1)如图所示的仪器中配制氢氧化钠溶液肯定不需要的是 ______________(填序号)

(2)下列操作中,容量瓶所不具备的功能有_________(填序号)。
A.配制一定体积准确浓度的标准溶液
B.贮存溶液
C.测量容量瓶规格以下的任意体积的液体
D.准确稀释某一浓度的溶液
E.用来加热溶解固体溶质
(3)根据计算用托盘天平称取NaOH的质量为__________g。配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次)____________。
A.用30mL水洗涤烧杯2-3次,洗涤液均注入容量瓶
B.准确称取计算量的氢氧化钠固体于烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解
C.将溶解的氢氧化钠溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度2~3cm处
(4)下图是实验室化学试剂浓硫酸标签上的部分内容。配制上述稀硫酸溶液需要用该浓硫酸和蒸馏水,可供选用的仪器有:胶头滴管;玻璃棒;烧杯。请回答下列问题:

①配制稀硫酸时,还缺少的仪器有_________________(写仪器名称)。
②经计算,所需浓硫酸的体积约为________mL;若将该浓硫酸与等体积的水混合,所得溶液中溶质的质量分数____________49%(填“>” 、“<” 或“=”)。
③对所配制的稀硫酸进行测定,发现其浓度大于0.5mol·L-1,配制过程中下列各项操作可能引起该误差的原因是________。
A容量瓶用蒸馏水洗涤后未经干燥
B用量筒量取浓硫酸时,仰视刻度线
C用量筒量取浓硫酸后,用蒸馏水将量筒洗涤干净,洗涤液转移到烧杯中
D转移溶液时,不慎有少量溶液洒出
E定容时,俯视容量瓶刻度线
F定容后,把容量瓶倒置摇匀,正放后发现液面低于刻度线,再加蒸馏水至刻度线
G未冷却溶液至室温就定容了
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省高二上第一次月考化学卷(解析版) 题型:选择题
下列说法或表示方法正确的是( )
A.等量的硫蒸气和硫固体分别完全燃烧,前者放出热量少
B.在稀溶液中:H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ/mol,若将含0.5molH2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热量大于57.3kJ
C.由C(石墨,s)→C(金刚石,s) △H=+1.5kJ/mol可知,金刚石比石墨稳定
D.在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l) △H=+285.8kJ/mol
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高一上第一次考试化学卷(解析版) 题型:选择题
在相同温度和压强下,4个容器中分别装有4种气体,已知各容器中的气体和容器的容积分别是a.CO2 100 mL;b.O2 200 mL;c.N2 400 mL;d.CH4 600 mL,则4个容器中气体的质量由大到小的顺序是
A.a>b>c>d B.b>a>d>c C.c>d>b>a D.d>c>a>b
查看答案和解析>>
科目:高中化学 来源:2017届江西省高三上学期第一次月考化学试卷(解析版) 题型:选择题
下列有关NaClO和NaCl混合溶液的叙述正确的是( )
A.该溶液中,H+、NH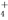 、SO
、SO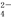 、Br-可以大量共存
、Br-可以大量共存
B.该溶液中,Ag+、K+、NO 、CH3CHO可以大量共存
、CH3CHO可以大量共存
C.向该溶液中滴入少量FeSO4溶液,反应的离子方程式:2Fe2++ClO-+2H+===Cl-+2Fe3++H2O
D.向该溶液中加入浓盐酸,每产生1 molCl2,转移电子约为6.02×1023个
查看答案和解析>>
科目:高中化学 来源:2017届湖南省长沙市高三上第12次周测化学卷(解析版) 题型:推断题
氯贝特是临床上一种降脂抗血栓药物,其结构如下图所示: 。
。
它的一条合成路线如下:提示:(图中部分反应条件及部分反应物、生成物已略去)

已知:

(1)氯贝特的分子式为 ,其中能发生水解反应的官能团名称为 。
(2)A→B的反应类型是 ,B的结构简式是 。
(3)要实现反应①所示的转化,加入下列物质不能达到目的的是 。
a.NaOH b.NaCl c.NaHCO3 d. Na
(4)由D生产的氯贝特的化学方程式为 。
(5)有机物甲有多种同分异构体,则同时满足一下条件的甲的所有同分异构体有种 。
①苯环上有2个取代基;②属于酯类;③既能与FeCl3溶液反应显紫色,又能发生银镜反应。
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上10月月考化学试卷(解析版) 题型:实验题
平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2、FeO等物质)。某课题组以此粉末为原料,设计如下工艺流程对资源进行回收,得到Ce(OH)4和硫酸铁铵:

已知:
①酸性条件下,铈在水溶液中有Ce3+、Ce4+两种主要存在形式,Ce3+易水解,Ce4+有较强氧化性。
②CeO2不溶于稀硫酸。
③硫酸铁铵[aFe2(SO4)3•b(NH4)2SO4•cH2O]广泛用于水的净化处理。
(1)在氧化环节,下列物质中最适合用作氧化剂B的是 (填序号)。
a.NaClO b.H2O2 c.KMnO4
(2)操作Ⅰ的名称是 ,检验硫酸铁铵溶液中含有NH4+的方法是 。
(3)写出反应②的化学方程式 。
(4)用滴定法测定制得的Ce(OH)4产品纯度。称取Ce(OH)4样品→加硫酸溶解→用0.1000mol/LFeSO4溶液滴定,所用FeSO4溶液在空气中露置一段时间后再进行滴定,则测得该Ce(OH)4产品的质量分数 。(填“偏大”、“偏小”或“无影响”)
(5)称取14.00g硫酸铁铵样品,将其溶于水配制成100mL溶液,分成两等份,向其中一份加入足量NaOH溶液,过滤洗涤沉淀并烘干灼烧至恒重得到1.60g固体;向另一份溶液中加入0.5mol/L Ba(NO3)2溶液100mL,恰好完全反应。通过计算,该硫酸铁铵的化学式为 。
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上10.6周测化学试卷(解析版) 题型:选择题
常温下,0.2mol·L-1的一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是
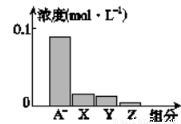
A.HA为强酸
B.该混合液pH=7
C.图中X表示HA,Y表示OH-,Z表示H+
D.该混合溶液中:c(A-)+c(Y)=c(Na+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com