
时间/min n(CH4)/mol 温度 | 0 | 10 | 20 | 40 | 50 |
| T1 | 1.00 | 0.70 | 0.50 | 0.20 | 0.20 |
| T2 | 1.00 | 0.60 | 0.36 | … | 0.30 |
| A. | 10 min内,T1时的化学反应速率比T2时大 | |
| B. | 温度:T1<T2 | |
| C. | Q>0 | |
| D. | 化学平衡常数:K(T1)<K(T2) |
分析 A.由表格中的数据计算υ(CH4);
B.温度升高,反应速率加快;
C.温度升高,甲烷剩余量增多,说明反应向左进行,正反应放热;
D.T1时反应进行的更为彻底.
解答 解:A.10 min内,T1时υ(CH4)=$\frac{\frac{0.3mol}{1L}}{10min}$=0.03mol•L-1•min-1,T2时时υ(CH4)=$\frac{\frac{0.4mol}{1L}}{10min}$=0.04mol•L-1•min-1,T1时υ(CH4)比T2时小,故A错误;
B.温度升高,反应速率加快,因此T2>T1,故B正确;
C.温度升高,甲烷剩余量增多,说明反应向左进行,正反应放热,所以Q<0,故C错误;
D.T1时反应进行的更为彻底,因此平衡常数更大,所以K(T1)>K(T2),故D错误;
故选:B.
点评 本题主要考查外界条件对化学反应速率以及平衡移动原理及其应用,难度中等以上,注意灵活运用所学知识.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
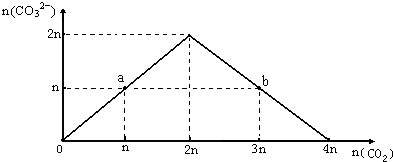 向NaOH溶液中缓慢通入CO2气体,溶液中CO32-的物质的量与通入CO2物质的量的关系图如下.下列关于图中a、b两点溶液的说法错误的是( )
向NaOH溶液中缓慢通入CO2气体,溶液中CO32-的物质的量与通入CO2物质的量的关系图如下.下列关于图中a、b两点溶液的说法错误的是( )| A. | a、b溶液与同浓度盐酸完全反应时,消耗盐酸的体积相同 | |
| B. | a溶液中水的电离程度与b溶液中水的电离程度相同 | |
| C. | a、b两溶液都满足:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-) | |
| D. | 将a、b两点混合后溶液满足:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
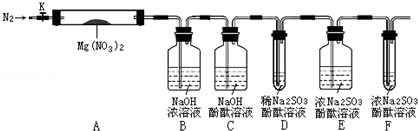
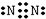 ,步骤Ⅱ中,通入一段时间N2的目的是避免对分解产物O2的检验产生干扰.
,步骤Ⅱ中,通入一段时间N2的目的是避免对分解产物O2的检验产生干扰.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MgSO4 | B. | Al(NO3)3 | C. | CuSO4 | D. | Na2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 将稀硫酸改成浓硫酸 | B. | 滴加少量硫酸钠溶液 | ||
| C. | 硫酸改成4 mol•L-1的醋酸 | D. | 滴加几滴硫酸铜溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径大小关系为Z>Y>X | |
| B. | 由X、Z、M、W四种元素形成的化合物都不能用于焙制糕点的食品工业 | |
| C. | 由X、Y、Z、M四种元素形成的所有化合物既能和强酸反应又能和强碱反应 | |
| D. | 由X与M形成的不同分子的空间构型可能是正四面体型、直线型或平面型等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 决定某化学反应反应速率的主要因素是催化剂 | |
| B. | 青霉素、橡胶、阿斯匹林全部由化学合成制得 | |
| C. | 铝有还原性,在反应中放出大量热能用来冶炼难熔金属Mn等 | |
| D. | 陶瓷品、酒精、乙烯塑料等的使用不会对环境造成污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4LCO和CO2的混合气体中所含的碳原子数一定是NA | |
| B. | 含1molHCl的盐酸溶液与足量Fe反应,Fe所失去的电子总数为2NA | |
| C. | 常温常压下,32gO2和32gO3所含氧原子数都是2NA | |
| D. | 1mol/L的Na2SO4溶液中含2NA个Na+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com