
| A. | 热化学方程式中,化学式前面的化学计量数只能表示物质的量 | |
| B. | 1 moL H2生成1 mol H20时放出的热量就是氢气的燃烧热的值 | |
| C. | 用1mol/L的硫酸和适量的稀的Ba(OH)2溶液反应可以测量中和热的值 | |
| D. | 条件相同,用16g固体硫或32 g固体硫分别在02中充分燃烧,测定的硫的燃烧热不同 |
分析 A.热化学方程式中的化学计量数表示物质的量,不能表示微粒数能为分数;
B.燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量;
C.中和热是强酸强碱稀溶液完全反应生成1mol水放出的热量;
D.燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量.
解答 解:A.热化学方程式中的化学计量数表示物质的量,不表示分子数,所以能为分数,故A正确;
B.1 moL H2生成1 mol液态 H20时放出的热量就是氢气的燃烧热的值,故B错误;
C.硫酸和氢氧化钡反应生成硫酸钡沉淀会放出热量,不能测量中和热的值,故C错误;
D.依据燃烧热概念分析可知,条件相同,用16g固体硫或32 g固体硫分别在02中充分燃烧,测定的硫的燃烧热相同,故D错误;
故选A.
点评 本题考查了化学反应能量变化,燃烧热、中和热概念的理解应用,题目较简单.


科目:高中化学 来源: 题型:解答题
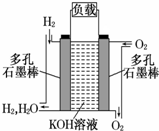 被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效 率的特点.如图为氢氧燃料电池的结构示意图,电解质溶液为KOH 溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连 续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题:
被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效 率的特点.如图为氢氧燃料电池的结构示意图,电解质溶液为KOH 溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连 续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 2:3 | C. | 2:1 | D. | 3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同温度下,Na2C03溶液中水的电离程度比纯水的电离程度小 | |
| B. | 相同温度下,Na2C03溶液中滴加酚酞呈红色,NaHC03溶液中滴加酚酞颜色更深 | |
| C. | VLamoL/L的Na2C03溶液中,若C032-的数目为NA;则Na+的数目大于2NA | |
| D. | CaC03在饱和Na2C03溶液中的KSP比在纯水中的KSP小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 提倡绿色出行 | B. | 提倡使用无磷洗涤剂 | ||
| C. | 提倡使用一次性塑料袋 | D. | 提倡垃圾分类和回收利用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 下列装置中,a5是铁电极,其余为石墨电极,烧杯中液体体积均为100mL,放置一段时间后(溶质都有剩余),回答下列问题(不考虑溶液体积变化)
下列装置中,a5是铁电极,其余为石墨电极,烧杯中液体体积均为100mL,放置一段时间后(溶质都有剩余),回答下列问题(不考虑溶液体积变化)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com