
| A. | 燃料燃烧,只是将化学能转化为了热能 | |
| B. | 人类使用照明设备,将电能转化为光能 | |
| C. | 生物体内的化学变化过程在能量转化上比在体外发生的一些能量转化更为合理有效 | |
| D. | 通过植物的光合作用,太阳能转化为化学能 |
分析 A.燃料燃烧将化学能转化为热能、光能等形式的能量;
B.照明设备是电能转化为光能;
C.人体内的能量变化能均衡能量;
D.植物的光合作用是把太阳能转化为化学能,吸入二氧化碳呼出氧气;
解答 解:A.燃烧是剧烈的发光放热的氧化还原反应,过程中可以变为光能、热能等,故A错误;
B.照明需要光能,人类使用照明设备是将电能转化为光能,故B正确;
C.人体内的能量变化是一个能量均衡的转化过程,生物体内的化学变化过程在能量转化上比体外发生的一些能量转化更为合理、有效,故C正确;
D.植物的光合作用是绿色植物和藻类利用叶绿素等光合色素和某些细菌利用其细胞本身,在可见光的照射下,将二氧化碳和水(细菌为硫化氢和水)转化为有机物,并释放出氧气(细菌释放氢气)的生化过程,使得太阳能转化为了化学能,故D正确;
故选A.
点评 本题考查了常见的能量转化形式,题目难度不大,注意知识的积累,B注意其它形式能的转化,为易错点.


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案科目:高中化学 来源: 题型:选择题
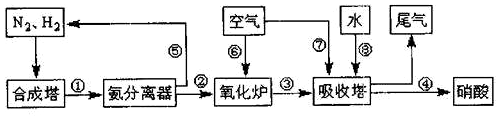
| A. | ②③⑤⑥⑦ | B. | ①④⑧ | C. | 只有①④ | D. | 只有⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (CH3)2CH CH2 CH2CH3 | B. | (CH3 CH2)2CHCH3 | ||
| C. | (CH3)3CCH2CH3 | D. | (CH3)2CHCH(CH3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑤ | B. | ①②④ | C. | ①③④ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在水中的溶解性:NaHCO3<Na2CO3 | |
| B. | 相同条件下,与等浓度盐酸反应生成CO2的速率:Na2CO3<NaHCO3 | |
| C. | 等物质的量的Na2CO3和NaHCO3分别与足量盐酸反应产生的CO2质量相同 | |
| D. | 等质量的Na2CO3和NaHCO3分别与足量盐酸反应,Na2CO3放出CO2更多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 有机物TPE具有聚集诱导发光特性,在光电材料领域应用前景广阔,其结构简式如图所示,下列说法正确的是( )
有机物TPE具有聚集诱导发光特性,在光电材料领域应用前景广阔,其结构简式如图所示,下列说法正确的是( )| A. | 该有机物的分子式为C26 H22 | |
| B. | 该有机物属于苯的同系物 | |
| C. | 该有机物的一氯代物有5种 | |
| D. | 该有机物既可发生氧化反应,又可发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

 ,D与E反应的现象是有白烟生成;D在催化剂作用下被氧气氧化是工业制备硝酸的主要反应之一,已知1molD被催化氧化生成气态物质放出aKJ的热量,请写出该反应的热化学反应方程式4NH3(g)+5O2(g)=4NO(g)+6H2O(l)△H=-4akJ/mol.
,D与E反应的现象是有白烟生成;D在催化剂作用下被氧气氧化是工业制备硝酸的主要反应之一,已知1molD被催化氧化生成气态物质放出aKJ的热量,请写出该反应的热化学反应方程式4NH3(g)+5O2(g)=4NO(g)+6H2O(l)△H=-4akJ/mol.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com