
| 选项 | 实验操作 | 解释或结论 |
| A | 向某溶液中滴加盐酸酸化的BaCl2溶液,出现白色沉淀 | 溶液中一定含有SO42- |
| B | 将某气体通入品红溶液中溶液褪色,加热褪色后的溶液,溶液又恢复原色 | 该气体为SO2 |
| C | 用蒸馏水润湿的pH试纸测溶液的pH | 一定会使测定结果偏低 |
| D | 向混有乙酸和乙醇的乙酸乙酯中加入氢氧化钠溶液 | 除溶液中的乙酸和乙醇 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.白色沉淀为AgCl或硫酸钡;
B.加热褪色后的溶液,溶液又恢复原色,可知二氧化硫与品红化合生成无色物质;
C.蒸馏水润湿的pH试纸测溶液的pH,不一定有误差;
D.乙酸、乙酸乙酯均与NaOH溶液反应.
解答 解:A.白色沉淀为AgCl或硫酸钡,则原溶液中可能含银离子或硫酸根离子,但二者不能同时存在,故A错误;
B.加热褪色后的溶液,溶液又恢复原色,为暂时性的漂白性,可知二氧化硫与品红化合生成无色物质,则该气体为SO2,故B正确;
C.蒸馏水润湿的pH试纸测溶液的pH,不一定有误差,如测定NaCl溶液的pH,故C错误;
D.乙酸、乙酸乙酯均与NaOH溶液反应,不能除杂,应利用饱和碳酸钠溶液来除杂,故D错误;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,涉及离子检验、漂白性物质、pH测定及混合物分离提纯等,把握物质的性质、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源: 题型:解答题
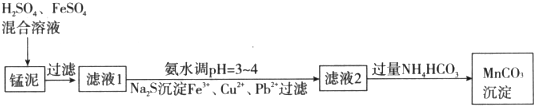
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | IA族,单质的熔点逐渐降低 | |
| B. | ⅥA族,对气态氢化物还原性逐渐增强 | |
| C. | VA族氢化物的沸点逐渐升高 | |
| D. | ⅣA族最高氧化物对应水化物的酸性逐渐增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用盐酸和淀粉-KI试纸检验碘盐中的KIO3:IO3-+5I-+6H+=3I2+3H2O | |
| B. | CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g)△H=-566.0KJ/mol | |
| C. | Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O | |
| D. | 在某钠盐溶液中含有等物质的量的Cl-、I-、AlO2-、CO32-、NO3-、SiO32-中若干种,当加入过量的盐酸产生气泡,溶液颜色变溶,则溶液中一定有CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钾具有强还原性,可用其余TiCl溶液反应制取金属Ti | |
| B. | 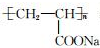 表示一种易溶于水的高分子树脂 表示一种易溶于水的高分子树脂 | |
| C. | 由于Si是一种很重要的半导体材料,故常用其来制作信息的传到材料-光导纤维 | |
| D. | 山东东营广饶县一男子子收到网购物品后,因吸人氟乙酸甲酯中毒身亡,氟乙酸甲酯的结构简式为FCH2COOCH3能与H2发生加成反应.也能被LiAlH4还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| pH | 2 | 4 | 6 | 6.5 | 8 | 13.5 | 14 |
| 腐蚀快慢 | 较快 | 慢 | abc 较快 | ||||
| 主要产物 | Fe2+ | Fe3O4 | Fe2O3 | FeO2- | |||
| A. | 当pH<4时,碳钢主要发生析氢腐蚀 | |
| B. | 当pH>6时,碳钢主要发生吸氧腐蚀 | |
| C. | 当pH>14时,正极反应为O2+4H++4e→2H2O | |
| D. | 在煮沸除氧气后的碱性溶液中,碳钢腐蚀速率会减缓 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
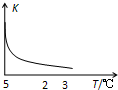 室温下,把SiO2细粉放入蒸馏水中,搅拌至平衡,生成H4SiO4溶液(SiO2+2H2O?H4SiO4),该反应平衡常数K随温度的变化如图示,搅拌1小时,测得H4SiO4的质量分数为0.01%(溶液密度为1.0g/mL),下列分析正确的是( )
室温下,把SiO2细粉放入蒸馏水中,搅拌至平衡,生成H4SiO4溶液(SiO2+2H2O?H4SiO4),该反应平衡常数K随温度的变化如图示,搅拌1小时,测得H4SiO4的质量分数为0.01%(溶液密度为1.0g/mL),下列分析正确的是( )| A. | 该反应平衡常数的表达式为K=c(H4SiO4) | |
| B. | 该生成H4SiO4的反应为吸热反应 | |
| C. | 用H4SiO4表示的反应速率为1.04×10-2mol/(L•h) | |
| D. | 若K值变大,在平衡移动时逆反应速率先减小后增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24LCCl4中含Cl原子数目为0.4NA | |
| B. | 白磷分子(P4)呈正四面体结构,12.4 g白磷中含有P-P键数目为0.6NA | |
| C. | 5.6 g铁粉在2.24l(标准状况)氯气中充分燃烧,失去的电子数为0.3NA | |
| D. | 常温常压下,10 g46%酒精水溶液中含氧原子总数为0.1NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com