
 ;U元素在周期表中的位置是第二周期IVA族.
;U元素在周期表中的位置是第二周期IVA族.分析 Y的单质在W2中燃烧的产物可使品红溶液褪色,该气体为SO2,则Y为S元素,W为O元素,Z的单质在W中燃烧生成的化合物Z3W4具有磁性,则Z3W4为Fe3O4,Z为Fe元素,U的单质在W2中燃烧可生成UW和UW2两种气体,U原子序数小于O元素,应为CO和CO2气体,U为C元素,X的单质是一种金属,该金属在UW2中剧烈燃烧生成黑、白两种固体,应为Mg和CO2的反应,则X为Mg元素,V的原子序数介于碳、氧之间,则V为N元素,据此解答.
解答 解:Y的单质在W2中燃烧的产物可使品红溶液褪色,该气体为SO2,则Y为S元素,W为O元素,Z的单质在W中燃烧生成的化合物Z3W4具有磁性,则Z3W4为Fe3O4,Z为Fe元素,U的单质在W2中燃烧可生成UW和UW2两种气体,U原子序数小于O元素,应为CO和CO2气体,U为C元素,X的单质是一种金属,该金属在UW2中剧烈燃烧生成黑、白两种固体,应为Mg和CO2的反应,则X为Mg元素,V的原子序数介于碳、氧之间,则V为N元素.
(1)V的单质为N2,结构式为N≡N,XW为MgO,为离子化合物,电子式为 ,U为碳元素,元素在周期表中的位置是:第二周期IVA族,
,U为碳元素,元素在周期表中的位置是:第二周期IVA族,
故答案为:N≡N; ;第二周期IVA族;
;第二周期IVA族;
(2)U为C元素,形成的单质有金刚石、石墨和C60等,分别属于原子晶体、混合晶体、分子晶体,
故答案为:①③;
(3)U、V、W形成的10电子氢化物分别是CH4、NH3、H2O,常温下水为液态,甲烷、氨气为气体,水的沸点最高,NH3含有氢键,沸点比甲烷的沸点高,故甲烷沸点最低,由于非金属性N<O,故氢化物稳定性:NH3<H2O,
故答案为:CH4;NH3<H2O;
(4)SO2通入过量的NaOH溶液,反应离子方程式为:SO2+2OH-=SO32-+H2O,
故答案为:SO2+2OH-=SO32-+H2O.
点评 本题考查元素化合物推断,需要学生熟练掌握元素化合物性质,关键是正确推断元素,需要学生具备扎实的基础,难度中等.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在某溶液中先加HNO3,无明显现象,再加入AgNO3溶液有白色沉淀产生,且沉淀不消失,则该溶液中一定有Cl- | |
| B. | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- | |
| C. | 做焰色反应前应先将铂丝在稀硫酸中洗干净再蘸取待测液进行实验 | |
| D. | 配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌条件下慢慢加入浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下不能用铝制容器贮存 | |
| B. | 露置在空气中,容器内酸液的质量都增加 | |
| C. | 常温下都能与铜剧烈反应 | |
| D. | 露置在空气中,容器内酸液的浓度都减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| a | |||
| b | |||
| c | d | ||
| e |
| A. | 元素b位于ⅥA族,有+6、-2两种常见化合价 | |
| B. | 五种元素中,元素e的性质最稳定 | |
| C. | 元素c和d的最高价氧化物对应水化物的酸性:c>d | |
| D. | 元素c和e的气态氢化物的稳定性:c>e |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向NaHSO4溶液中滴加Ba(OH)2溶液至中性:Ba2++OH-+H++SO42-=BaSO4↓+H2O | |
| B. | 向饱和Na2CO3溶液中通入足量CO2:2Na++CO32-+CO2+H2O=2NaHCO3↓ | |
| C. | 向Ca(HCO3)2溶液中加入足量Ca(OH)2溶液:Ca2++HCO3-+2OH-=CaCO3↓+CO32-+2H2O | |
| D. | 硫酸溶液于氢氧化钡溶液混合:H++SO42-+Ba2++OH-=BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
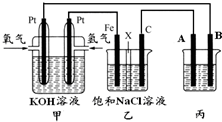 某同学设计一个燃料电池(如图所示),目的是探究氯碱工业原理和电镀的原理,其中乙装置中X为阳离子交换膜.
某同学设计一个燃料电池(如图所示),目的是探究氯碱工业原理和电镀的原理,其中乙装置中X为阳离子交换膜.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com