
| A. | 凡是中心原子采取sp3杂化轨道成键的分子其几何构型都是正四面体 | |
| B. | CH4分子中的sp3杂化轨道是由4个H原子的1s 轨道和C原子的2p轨道混合起来而形成的 | |
| C. | 乙炔分子中,两个碳原子均采用sp2杂化轨道成键 | |
| D. | sp3杂化轨道是由同一个原子中能量相近的s 轨道和p轨道混合起来形成的一组能量相等的新轨道 |
分析 A.中心原子采取sp3杂化的分子,VSEPR模型是正四面体,但其立体构形不一定是正四面体;
B.甲烷分子中碳原子含有s-p σ键和杂化以后形成的σ键;
C.每个碳原子含有2个σ键且不含孤电子对,所以采取sp杂化;
D.sp3杂化轨道,中心原子含有4个价层电子对,由同一个原子中能量相近的s轨道和p轨道混合起来形成的一组新轨道.
解答 解:A.中心原子采取sp3杂化的分子,VSEPR模型是正四面体,但其立体构形不一定是正四面体,如:水和氨气分子中中心原子采取sp3杂化,但H2O是V型,NH3是三角锥型,故A错误;
B.甲烷分子中碳原子含有4个σ键且不含孤电子对,所以碳原子以sp3杂化,分子中的碳原子以2个2s电子和2个2p电子分别与4个氢原子的1s轨道重叠,形成4个C-Hσ键,故B错误;
C.乙炔分子中每个C原子含有2个σ键和2个π键,价层电子对个数是2,为sp杂化,故C错误;
D.同一个原子中能量相近的s轨道和p轨道通过杂化可形成混合起来形成的一组能量相同的新轨道,杂化轨道数=孤电子对数+与之相连的原子数,故D正确;
故选D.
点评 本题考查了分子的空间构型的判断、杂化方式的判断等知识点,注意甲烷分子中4个C-H化学键如何形成的,为易错点,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | ①④⑥ | B. | ②③⑤ | C. | ③④⑤ | D. | 全有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 30g | B. | 40g | C. | 70g | D. | 80g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素周期表中X位于Y的上一周期 | |
| B. | 将H2X、HY分别加热至500℃,只有HY发生分解 | |
| C. | X的含氧酸的酸性强于Y的含氧酸的酸性 | |
| D. | X与Y同主族,相同温度时,二者的单质与铜反应分别生成Cu2X、CuY |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
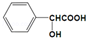
 +NaOH→
+NaOH→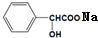 +H2O.
+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
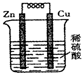
| A. | 铜片为正极,锌片为负极 | B. | 锌片溶解,质量减少 | ||
| C. | 铜片上有气泡产生 | D. | 电子由铜片经导线流向锌片 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com