
| A. | MgSO4═Mg2++SO42- | B. | Fe(OH)3═Fe3++3OH- | ||
| C. | NaHCO3═Na++HCO3- | D. | KAl(SO4)2═K++Al3++2SO42- |
分析 A.硫酸镁为强电解质,完全电离,用等号;
B.氢氧化铁为弱电解质,部分电离,用可逆号;
C.碳酸氢钠为强电解质,完全电离;
D.硫酸铝钾为强电解质,完全电离,用等号.
解答 解:A.硫酸镁为强电解质,完全电离,电离方程式:MgSO4═Mg2++SO42-,故A正确;
B.氢氧化铁为弱电解质,部分电离,电离方程式:Fe(OH)3 Fe3++3OH-,故B错误;
C.碳酸氢钠为强电解质,完全电离,电离方程式:NaHCO3═Na++HCO3-,故C正确;
D.硫酸铝钾为强电解质,完全电离,电离方程式:KAl(SO4)2═K++Al3++2SO42-,故D正确;
故选:B.
点评 本题考查了电解质电离方程式的书写,明确电解质强弱及电离方式是解题关键,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1mol N≡N键断裂的同时,有3mOLH-H键形成 | |
| B. | 1molN≡N键断裂的同时,有3molH-H键断裂 | |
| C. | 1molN≡N键断裂的同时,有6molN-H键形成 | |
| D. | 1molN≡N键断裂的同时,有6molN-H键断裂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硅和生石灰的熔化 | B. | 加热氯化铵和水 | ||
| C. | 碘和干冰的升华 | D. | 氯化钠和硫的汽化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入硝酸酸化的Ba(NO3)2 | B. | 先加HNO3酸化,再加Ba(NO3)2溶液 | ||
| C. | 先加盐酸酸化,再加BaCl2溶液 | D. | 加入盐酸酸化了的BaCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 红褐色、灰绿色、白色 | B. | 白色、红褐色、黑色 | ||
| C. | 白色、灰绿色、红褐色 | D. | 蓝色、灰绿色、绿色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
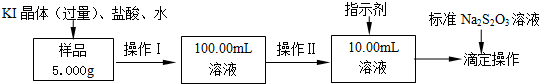
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mL | B. | 3 mL | C. | 5 mL | D. | 7 mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com