
【题目】已知水在25℃和95℃时,其电离平衡曲线如图所示:

(1)则25 ![]() 时水的电离平衡曲线应为_______(填“A”或“B”), 请说明理由____________________________________
时水的电离平衡曲线应为_______(填“A”或“B”), 请说明理由____________________________________
(2)25![]() 时,将pH=9的NaOH溶液与pH=3的H2SO4溶液混合,若所得混合溶液的 pH=7,则NaOH溶液与H2SO4溶液的体积比为_________
时,将pH=9的NaOH溶液与pH=3的H2SO4溶液混合,若所得混合溶液的 pH=7,则NaOH溶液与H2SO4溶液的体积比为_________
(3)95![]() 时,若100体积 pH1=a 的某强酸溶液与10体积 pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的 pH1与强碱的 pH2之间应满足的关系是__________________
时,若100体积 pH1=a 的某强酸溶液与10体积 pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的 pH1与强碱的 pH2之间应满足的关系是__________________
(4)曲线B对应温度下,pH=2的某HA溶液和pH=10的NaOH溶液等体积混合后,混合溶液的pH=5。请分析其原因:____________________________________________________
【答案】A 水的电离是吸热过程 ,温度低时,电离程度小,c(H+)、c (OH-)小 100 : 1 a+b=13 或 pH1+pH213 曲线B对应95℃,此时水的离子积为10-12。HA为弱酸,HA中和NaOH后,混合溶液中还剩余较多的HA分子,可继续电离出H+,使溶液pH=5
【解析】
(1)横轴是氢离子浓度,纵轴是氢氧根离子浓度,水的离子积常数KW=c(H+)c(OH-)计算出A曲线的KW值结合水的电离时吸热比较判断25℃时水的电离平衡曲线;
(2)先根据温度和混合溶液pH大小确定溶液中氢离子、氢氧根离子浓度,再列式计算出酸和碱的体积之比;
(3)酸、碱都是强电解质,溶液呈中性说明氢离子和氢氧根离子的物质的量相等,结合水的离子积常数确定强酸的pH1与强碱的pH2之间应满足的关系;
(4)曲线B对应95℃,pH=2的某酸HA中氢离子浓度与pH=10的NaOH溶液中氢氧根离子浓度相等,HA若为强酸,完全反应后pH=6,实际上pH=5,说明酸过量,则该酸为弱酸。
(1)水的电离是吸热过程,升高温度,使水的电离程度增大,当温度升高时,促进水的电离,水的离子积增大,水中氢离子、氢氧根离子浓度都增大,水的pH减小,但溶液仍然呈中性;
故答案为:A ;水的电离是吸热过程,温度低时,电离程度小,c(H+)、c(OH-)小;
(2)25 ℃时纯水的pH=7,所得混合溶液的pH=7,溶液呈中性即酸碱恰好中和,即n(OH-)=n(H+),则V(NaOH)·10-5mol·L-1=V(H2SO4)·10-3mol·L-1,得V(NaOH)∶V(H2SO4)=100:1,故答案为:100 :1;
(3)要注意的是95°C时,水的离子积为10-12,即酸、碱浓度相等时pH(酸)+pH(碱)=12。现强碱的OH-浓度是强酸H+浓度的10倍,所以pH(酸)+pH(碱)=13,即pH1+pH2=13,或a+b=13;
故答案为:a+b=13 或 pH1+pH213;
(4)曲线B对应95℃,pH=2的某酸HA中氢离子浓度与pH=10的NaOH溶液中氢氧根离子浓度相等,HA若为强酸,完全反应后pH=6,实际上pH=5,说明酸过量,则该酸为弱酸,HA中和NaOH后,混合溶液中还剩余较多的HA分子,可继续电离出H+,导致溶液中氢离子浓度大于氢氧根离子浓度而使溶液呈酸性;
故答案为:曲线B对应95℃,此时水的离子积为10-12,HA若为强酸,最后应为pH=6,现pH=5,说明HA为弱酸,HA中和NaOH后,混合溶液中还剩余较多的HA分子,可继续电离出H+。


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:
【题目】用下图所示装置除去含有CN-、Cl-废水中的CN-时,控制溶液的pH值为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是

A. 用石墨作阳极,铁作阴极
B. 阳极的电极反应式为:Cl-+2OH--2e-=== ClO-+H2O
C. 阴极附近碱性增强,阳极附近碱性减弱
D. 除去CN-的反应:5ClO-+2CN-+2H+ === N2↑+2CO2↑+5Cl-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,若锥形瓶内是水,分液漏斗内的液体也是水,向烧杯内滴加水时,发现U形管内液面左边低于右边,恢复到原温度后液面左边与右边基本相平,则烧杯内的物质是( )
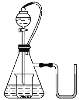
A.过氧化钠B.氧化钠C.钠D.氯化钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,N2与H2反应过程中的能量变化如图所示。下列叙述正确的是

A. 正反应的活化能等于逆反应的活化能
B. a曲线是加入催化剂时的能量变化曲线
C. 1 mo N2与3 mo H2充分反应放出的热量小于92 kJ
D. 加入催化剂,该反应的焓变减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常采用吸收-电解联合法除去天然气中的H2S气体,并转化为可回收利用的单质硫,其装置如下图所示。通电前,先通入一段时间含H2S的甲烷气,使部分NaOH吸收H2S转化为Na2S,再接通电源,继续通入含杂质的甲烷气,并控制好通气速率即可保证装置中反应的连续性。下列说法正确的是

A. 与电源a端相连的碳棒为阳极,气体A为O2
B. 与电源b端相连的碳棒上电极反应为:2H2O+2e-=2OH-+H2↑
C. 通电过程中,右池溶液中的OH-通过阴离子膜进入左池
D. 在通电前后,右池中的c(NaOH)与c(Na2S)之比基本不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】观察是研究物质性质的一种基本方法。一同学将一小块金属钠露置于空气中,观察到下列现象:银白色![]() 变灰暗
变灰暗![]() 变白色
变白色![]() 出现液滴
出现液滴![]() 白色固体,下列说法正确的是( )
白色固体,下列说法正确的是( )
A.①发生了化合反应B.②变白色是因为生成了碳酸钠
C.③是碳酸钠吸收空气中的水蒸气形成了溶液D.④只发生物理变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 时,先将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol/L的KOH溶液。此过程中溶液pH变化的曲线如图所示。下列叙述中正确的是
时,先将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol/L的KOH溶液。此过程中溶液pH变化的曲线如图所示。下列叙述中正确的是![]()
![]()

A. ①点的溶液中:c(H+)=c(Cl-)+c(HClO)+c(OH-)+c(ClO-)
B. ②点的溶液中:c(H+)> c(Cl-)>c(ClO-)> c(HClO)
C. ③点的溶液中:c(K+)=c(ClO-)+c(Cl-)
D. ④点的溶液中:c(K+)>c(ClO-)>c(Cl-)>c(HClO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数的数值。请回答下列问题:
(1)0.5mol SO2共含有约_______个原子,它与_______g SO3所含硫原子数相等。
(2)质量相同的①HCl、②NH3、③CO2、④O2四种气体中,在同温同压条件下,所占体积最小的是(填序号)___________。
(3)19g某二价金属氯化物(ACl2)中含有0.4mol Cl-,则ACl2的摩尔质量是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒容容器中发生反应2SO2(g)+O2(g)![]() 2SO3(g)△H<0,下列说法不正确的是
2SO3(g)△H<0,下列说法不正确的是
A. 容器内压强不再变化,说明反应达到平衡状态
B. 当c(SO2):c(O2)=1:2且保持不变,能表明反应达到平衡状态
C. 加入合适的催化剂可显著增大反应速率
D. 达到平衡状态时,相同时间内,每消耗2molSO3的同时生成1molO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com