
【题目】下列说法正确的是
A. 常温下同浓度的强酸、强碱等体积混合后由水电离出的c(H+)一定为10-7mol·L-l
B. 常温下pH =2的盐酸和pH =12的氨水等体积混合后生成NH4Cl,溶液显酸性
C. 常温下0.1 mol·L-1的Na2A溶液的pH=10,则该溶液中由水电离的c(OH-)= 10-10 mol·L-l
D. 常温下向CH3COONa稀溶液中加入CH3COONa固体,c (CH3COO-)/c(Na+)比值变大
【答案】D
【解析】
A.常温下,同浓度的强酸、强碱等体积混合后,由于没有告诉酸中含有氢离子、碱中含有氢氧根离子数目,则混合液不一定呈中性,由水电离出的c(H+)不一定为10-7mol.L-1,故A错误;
B. 常温下pH=2的盐酸和pH=12的氨水等体积混合后,混合液中氨水过量,溶液呈碱性,则c(H+) < c(OH-),故B错误;
C. 常湿下,0.1 mol·L-1的Na2A溶液的pH=10,A2-离子水解促进了水的电离,该溶液中氢氧根离子是水的电离的,则该溶液中由水电离的c(OH-)=10-4molL-1,故C错误;
D.CH3COONa溶液中醋酸根离子发生水解:CH3COO-+H2O![]() CH3COOH+OH-,加入CH3COONa固体后,增大了CH3COONa浓度,溶液水解程度减小,c(CH3COO-)/c(Na+)比值变大,故D正确;
CH3COOH+OH-,加入CH3COONa固体后,增大了CH3COONa浓度,溶液水解程度减小,c(CH3COO-)/c(Na+)比值变大,故D正确;
综上所述,本题选D。


 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源: 题型:
【题目】下列关于物质的量的叙述中,错误的是 ( )
A.1mol 任何物质都含有6.02×1023个分子B.0.012kg12C中含有约6.02×1023个碳原子
C.1mol H2O中含有2molH和1molOD.1mol C中约含有3.612×1024个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在不同的条件下进行合成氨反应,N2 (g)+3H2 (g)![]() 2NH3(g),根据下列在相同时间内测得的结果判断,生成氨的反应速率最快的是( )
2NH3(g),根据下列在相同时间内测得的结果判断,生成氨的反应速率最快的是( )
A. v(NH3)=0.1mol/(L·min) B. v(NH3)=0.2mol/(L·min)
C. v(N2)=0.3mol/(L·min) D. v(H2)=0.4mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,等质量的CH4、H2、O2、N2四种气体,体积最大的是____,(填化学式,下同),分子数最多的是____,密度最大的是____,原子数最多的是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以软锰矿(主要成分为MnO2)和硫锰矿(主要成分为MnS)为原料制备硫酸锰晶体的工艺流程如下:
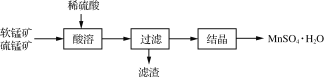
(1)滤渣中存在一种非金属单质,则酸浸过程中的化学方程式为_________________________________。
(2)实验室常用氧化还原法测定MnSO4·H2O晶体的纯度,原理如下:2Mn2++NO3-+4PO43-+2H+===2[Mn(PO4)2]3-+NO2-+H2O NH4++NO2-===N2↑+2H2O [Mn(PO4)2]3-+Fe2+===Mn2++[Fe(PO4)2]3-;称取MnSO4·H2O样品1.000 0 g,溶于适量水,以磷酸作配位剂,加入过量硝酸铵,在220~240 ℃下充分反应。然后以N—苯代邻氨基苯甲酸作指示剂,用0.100 0 mol·L-1硫酸亚铁铵标准溶液滴定生成的[Mn(PO4)2]3-至终点。重复操作3次,记录数据如下表:
滴定次数 | 标准液读数mL | |
滴定前 | 滴定后 | |
1 | 0.10 | 20.20 |
2 | 1.32 | 21.32 |
3 | 1.05 | 20.95 |
①已知:Fe2++NO2-+2H+===Fe3++NO↑+H2O。
测定过程中,硝酸铵的作用是____________________和____________________。
②若滴定过程中标准溶液硫酸亚铁铵不是新配置的,所测定的MnSO4·H2O晶体的纯度将会________(填“偏高”“偏低”或“不变”)。
③计算样品中MnSO4·H2O的质量分数(写出计算过程)__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象所得出的结论正确的是( )
选项 | 实验操作和现象 | 结论 |
A | 取久置的Na2O2粉末,向其中滴加过量的盐酸,产生无色气体 | Na2O2没有变质 |
B | 取少许CH3CH2Br与NaOH溶液共热,冷却后滴加AgNO3溶液,最终无淡黄色沉淀 | CH3CH2Br没有水解 |
C | 室温下,用pH试纸测得:0.1 mol·L-1 Na2SO3溶液的pH约为10,0.1 mol·L-1 NaHSO3溶液的pH约为5 | HSO |
D | 向少量碘水中加入过量浓FeCl2溶液,分成两等份,向一份中滴加KSCN溶液显红色;向另一份中滴加淀粉溶液显蓝色 | Fe3+与I-的反应为可逆反应 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以钛铁矿[主要成分为钛酸亚铁(FeTiO3),含有MgO、SiO2 等杂质]为原料,制备金属钛和铁红的工艺流程如下:已知:①酸溶时,FeTiO3转化为Fe2+和TiO2+;②本实验温度下,Ksp[Mg(OH)2]= 1.0×10-11;请回答下列问题:
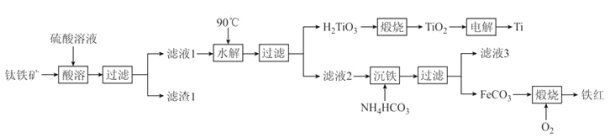
(1)FeTiO3中Ti元素的化合价为_______价。铁红的用途为________________(任写一种)。
(2)“水解”中,发生反应的离子方程式为____________________________________________。
(3)“沉铁”中,气态产物的电子式为_________;该过程需控制反应温度低于35℃,原因为_____________。
(4)FeCO3转化为铁红时,发生反应的化学方程式为________________________________________。
(5)滤液3可用于制备Mg(OH)2。若滤液3 中c(Mg2+)=1.2×10-4 mol·L-1,向其中加入等浓度等体积的NaOH溶液时,通过计算说明有无沉淀生成______________________________(溶液体积近似叠加)。
(6)电解生产钛时用TiO2和石墨做电极,电解质为熔融的CaO,则阴极反应式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对文中描述内容的相关解释正确的是( )
选项 | 描述 | 解铎 |
A | 丹砂烧之成水银,积变又还成丹砂 | 两个反应互为可逆反应 |
B | 凡埏泥造瓦,掘地二尺余,择取无沙粘土而为之 | 其中“瓦”的主要成分为硅酸盐 |
C | 硝石(KNO3)如握盐雪不冰,强烧之,紫青烟起 | 产生“紫青烟”的原因为KNO3分解 |
D | 其法用浓酒精和槽入瓶,蒸令气上,用器承滴露 | 其中涉及的操作方法为蒸发浓缩 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种形状像布袋结构的烯烃分子,其形状和结构如图所示,有关说法不正确的是( )
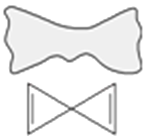
A. 该烯烃的分子式为C5H4
B. 该分子所有碳原子在同一平面
C. 1 mol该有机物最多可与2 mol Br2发生加成反应
D. 与其互为同分异构体且只含三键的链烃不止—种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com