
| 0.5mol/L×0.004L×2mol |
| 1mol |


科目:高中化学 来源: 题型:
 用如图所示的装置制取、提纯并收集表中的四种气体,图中a、b、c表示相应仪器加入的试剂,未考虑尾气处理的问题,其中可行的是( )
用如图所示的装置制取、提纯并收集表中的四种气体,图中a、b、c表示相应仪器加入的试剂,未考虑尾气处理的问题,其中可行的是( )| 气体 | a | b | C | |
| A | NH3 | 浓氨水 | 生石灰 | 碱石灰 |
| B | NO | 稀硝酸 | 铜片 | 碱石灰 |
| C | HCl | 浓硫酸 | 浓盐酸 | 氯化钙 |
| D | SO2 | 浓硫酸 | 铜片 | 硅胶 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
 根据物质结构与性质的关系,请回答下列问题:
根据物质结构与性质的关系,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
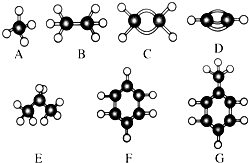 A~G是几种烃的分子球棍模型,据此回答下列问题:
A~G是几种烃的分子球棍模型,据此回答下列问题: 的名称是:
的名称是:查看答案和解析>>
科目:高中化学 来源: 题型:
| X |
| X |
| H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、压强降低,反应减慢 |
| B、温度降低,反应加快 |
| C、使CO2浓度增加,反应加快 |
| D、使O2浓度增加,反应加快 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com