
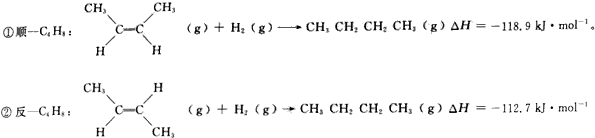


分析 (1)将方程式①-②得目标方程式,焓变进行相应的改变;
可逆反应达到平衡状态时,正逆反应速率相等,反应体系中各物质的物质的量、物质的量浓度、百分含量以及由此引起的一系列物理量不变;
若要进一步提高体系中反C4H8的含量可以采用降低温度的方法;
(2)①反应I放出热量,说明反应物总能量大于生成物总能量;反应II应该吸收热量,则反应物总能量小于生成物总能量;
②随反应进行,粗镍减少的质量即为参加反应①消耗的镍的质量,粗镍的纯度98.5%,1-10min内粗镍质量减少100g-41g=59g;镍的质量=59g×98.5%=58.115g在0~10min,生成Ni的物质的量=$\frac{(100-41)g×98.5%}{59g/mol}$=0.985mol,v=$\frac{\frac{n}{V}}{△t}$;
③若反应Ⅱ达到平衡后,保持其他条件不变,降低温度,正逆反应速率都减小,平衡逆向移动;
④50℃Ni反应生成Ni(CO)4,230℃时Ni(CO)4分解生成Ni,通过改变温度设计实验.
解答 解:(1)将方程式①-②得目标方程式,△H=(-119.8kJ/mol)-(-112.7kJ/mol)=-62kJ/mol;
a.顺-C4H8的含量保待不变时,正逆反应速率相等,反应达到平衡状态,故正确;
b.无论反应是否达到平衡状态,混合气体的平均摩尔质量始终保持不变,不能据此判断平衡状态,故错误;
c.无论反应是否达到平衡状态,混合气体中碳的质量分数始终保持不变,不能据此判断平衡状态,故错误;
故选a;
该反应的正反应是放热反应,若要进一步提高体系中反C4H8的含量可以采用降低温度的方法;
故答案为:-6.2kJ•mol-1;a;降低温度;
(2)①反应I放出热量,说明反应物总能量大于生成物总能量;反应II应该吸收热量,则反应物总能量小于生成物总能量,只有a符合,故选a;
②随反应进行,粗镍减少的质量即为参加反应①消耗的镍的质量,粗镍的纯度98.5%,1-10min内粗镍质量减少100g-41g=59g;镍的质量=59g×98.5%=58.115g在0~10min,生成Ni的物质的量=$\frac{(100-41)g×98.5%}{59g/mol}$=0.985mol,故在0~10min,v[Ni(CO)4]=$\frac{\frac{0.985mol}{2L}}{10min}$=0.985mol/(2L×10min)=0.05mol/(L•min);
故答案为:0.05mol/(L•min);
③若反应Ⅱ达到平衡后,保持其他条件不变,降低温度,正逆反应速率都减小,平衡逆向移动,平衡常数减小、CO浓度减小、v正[Ni(CO)4]减小,故选b;
④50℃Ni反应生成Ni(CO)4,230℃时Ni(CO)4分解生成Ni,通过改变温度设计实验,实验设计方案为控制温度在50℃,一段时间后在玻璃管的另一端加热至230℃,即可在该端获得纯净的镍,
故答案为:控制温度在50℃,一段时间后在玻璃管的另一端加热至230℃,即可在该端获得纯净的镍.
点评 本题考查化学平衡计算、化学平衡移动影响因素、化学平衡状态判断等知识点,侧重考查学生分析判断、计算及知识灵活运用能力,难点是实验方案设计,要根据两个方程式差异性设计实验,题目难度中等.


 53天天练系列答案
53天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 研究物质的性质时,常用到观察、实验、分类、比较、模型、假设等方法 | |
| B. | 研究物质性质的一般程序的第二步是观察物质的外观 | |
| C. | 可以用分类的方法预测物质的性质 | |
| D. | 观察是一种有计划、有目的地用感官考察研究对象的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 组别 | c(一元酸) | c(NaOH)/mol•L-1 | 混合溶液的pH |
| 甲 | c(HX)=0.1mol•L-1 | 0.1 | pH=x |
| 乙 | c(HY)=0.1mol•L-1 | 0.1 | pH=7 |
| 丙 | c(HZ)=0.1mol•L-1 | 0.1 | pH=9 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
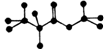
| A. | 该物质在酸性条件下水解生成乙酸 | |
| B. | 该物质含有双键,能跟氢气发生加成反应 | |
| C. | 该物质属于酯类 | |
| D. | 分子式为C3H8O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 在$\frac{C{u}_{2}O}{ZnO}$做催化剂的条件下,将1molCO(g)和2molH2(g)充入容积为2L的密闭容器中合成CH3OH(g),反应过程中,CH3OH(g)的物质的量(n)与时间(t)及温度的关系如图所示:
在$\frac{C{u}_{2}O}{ZnO}$做催化剂的条件下,将1molCO(g)和2molH2(g)充入容积为2L的密闭容器中合成CH3OH(g),反应过程中,CH3OH(g)的物质的量(n)与时间(t)及温度的关系如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 甲 | 乙 | 丙 | 丁 | ||
| 密闭容器体积/L | 2 | 2 | 2 | 1 | |
| 起始物质的量 | n(SO2)/mol | 0.40 | 0.80 | 0.80 | 0.40 |
| n(O2)/mol | 0.24 | 0.24 | 0.48 | 0.24 | |
| SO2的平衡转化率% | 80 | α1 | α2 | α3 | |
| A. | 甲中反应的平衡常数小于乙 | |
| B. | 该温度下,该反应的平衡常数K为400 | |
| C. | SO2的平衡转化率:α1>α2=α3 | |
| D. | 容器中SO3的物质的量浓度:丙=丁<甲 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
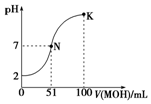 常温下,向100mL 0.01mol•L-1 HA溶液中逐滴加入0.02mol•L-1 MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).回答下列问题:
常温下,向100mL 0.01mol•L-1 HA溶液中逐滴加入0.02mol•L-1 MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com