
分析 水的电离方程式为:H2O?H++OH-,酸或碱抑制水电离,含有弱根离子的盐促进水电离,据此分析解答.
解答 解:酸或碱抑制水电离,含有弱根离子的盐促进水电离,常温下,kw=c(H+)×c(OH-)=1×10-14,纯水中c(H+)=1×10-7 mol•L-1,该溶液中由水电离产生的c(OH-)=1×10-11 mol•L-1<1×10-7 mol•L-1,说明该溶液抑制水电离,所以该溶液可能是酸也可能是碱,如果是酸溶液,则溶液中氢离子浓度是0.001mol/L,溶液的pH=3,如果是碱溶液,则溶液中氢原子浓度是1×10-11 mol•L-1,溶液的pH=11,
故答案为:3或11.
点评 本题考查了pH的简单计算,明确哪些物质促进水电离哪些物质抑制水电离是解本题关键,题目难度中等.


 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:选择题
| A. | 12种 | B. | 14种 | C. | 16种 | D. | 18种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
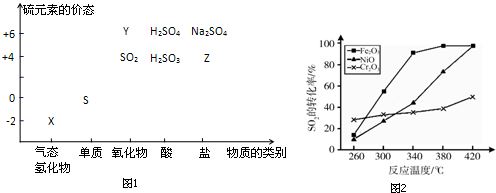
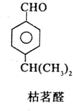
 ;其水溶液在空气中放置易变浑浊,写出反应的化学方程式2H2S+O2→2S↓+2H2O;该变化说明S的非金属性比O弱(填“强”或“弱”),从原子结构的角度解释原因:硫原子半径大于氧原子,硫原子的电子能力小于氧原子.通过H2O的稳定性大于H2S或SO2中硫是+4价,氧是-2价(举两例),也可以判断氧、硫两种元素的非金属性强弱.
;其水溶液在空气中放置易变浑浊,写出反应的化学方程式2H2S+O2→2S↓+2H2O;该变化说明S的非金属性比O弱(填“强”或“弱”),从原子结构的角度解释原因:硫原子半径大于氧原子,硫原子的电子能力小于氧原子.通过H2O的稳定性大于H2S或SO2中硫是+4价,氧是-2价(举两例),也可以判断氧、硫两种元素的非金属性强弱.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 目前加碘食盐中主要添加的是KI | |
| B. | 光化学烟雾与大量排放碳氢化合物和氮氧化合物有关 | |
| C. | 淀粉、纤维素和聚乙烯都属于天然高分子化合物 | |
| D. | 光纤通信使用的光缆的主要成分和太阳能电池使用的材料都是SiO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用米汤检验含碘盐中的碘酸钾 | |
| B. | 纤维素、蛋白质、塑料、天然橡胶都是高分子化合物 | |
| C. | 日常生活中常用无水乙醇进行杀菌消毒 | |
| D. | 光化学烟雾、臭氧层空洞、温室效应、硝酸型酸雨的形成都与氮氧化合物有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时,正极区溶液的pH减小 | |
| B. | 该电用电可用稀H2SO4代替KOH溶液 | |
| C. | 充电时,电解质溶液中的K+等阳离子向Zn电极移动 | |
| D. | 充电时,每转移3 mol电子,阳极有1 mol Fe(OH)3被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 $→_{一定条件}^{试剂X}$A
$→_{一定条件}^{试剂X}$A B$→_{一定条件}^{2H_{2},Ni}$C$→_{△}^{Cu,O_{2}}$
B$→_{一定条件}^{2H_{2},Ni}$C$→_{△}^{Cu,O_{2}}$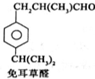
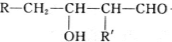 $→_{-H_{2}O}^{△}$
$→_{-H_{2}O}^{△}$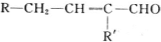
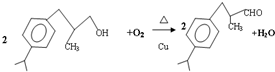 +H20.
+H20.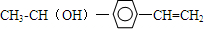 、
、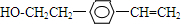 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠和水反应:Na+2H2O=Na++2OH-+H2↑ | |
| B. | 等物质的量的Ba(OH)2与NH4HSO4在稀溶液中反应:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O | |
| C. | 用过氧化氢从酸化的海带灰浸出液中提取碘:2I-+H2O2=I2+2OH- | |
| D. | 向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com