
| A.锂在空气中燃烧生成过氧化锂 |
| B.根据对角线规则,锂与镁性质相似,蒸发、灼烧氯化锂溶液得到LiCl固体,电解该LiCl得到锂和氯气 |
| C.实验室锂保存在煤油中,防止锂与水、氧气反应 |
| D.“空中焰火”中既有物理变化又有化学变化 |
科目:高中化学 来源:不详 题型:单选题
| A.合金的性质等于各成分金属的性质之和 |
| B.单质铝既能溶于盐酸,又能溶于NaOH溶液 |
| C.镁着火可以用CO2灭火器来灭火 |
| D.最外层只有一个电子的元素一定是金属元素 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
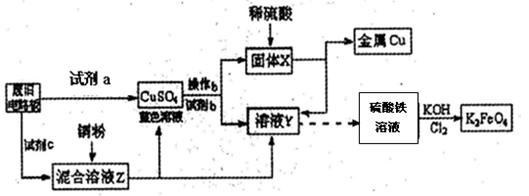
| A.浓硫酸 | B.硫酸铁溶液 | C.氯水 | D.H2 O2和稀硫酸 E. Fe |
 3Zn(OH)2+2Fe(OH)3+4KOH,电池工作时在正极放电的物质是: 。
3Zn(OH)2+2Fe(OH)3+4KOH,电池工作时在正极放电的物质是: 。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
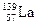 )组成的一种合金LaNix是较好的储氢材料,能快速可逆地存储和释放H2。LaNix的晶胞如图,其储氢原理为:镧镍合金吸附H2,H2解离为原子,H储存在其中形成LaNixH6。LaNixH6中,x= 。该贮氢的镧镍合金、泡沫氧化镍、氢氧化钾溶液组成的镍氢电池被用于制作原子钟,反应原理为:
)组成的一种合金LaNix是较好的储氢材料,能快速可逆地存储和释放H2。LaNix的晶胞如图,其储氢原理为:镧镍合金吸附H2,H2解离为原子,H储存在其中形成LaNixH6。LaNixH6中,x= 。该贮氢的镧镍合金、泡沫氧化镍、氢氧化钾溶液组成的镍氢电池被用于制作原子钟,反应原理为: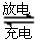 LaNix+y NiO+y H2O。写出其放电时负极的电极反应方程式
LaNix+y NiO+y H2O。写出其放电时负极的电极反应方程式 
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 、FeO、Fe2O3,Ti的最高化合价为+4)作原料,生产白色颜料二氧化钛的
、FeO、Fe2O3,Ti的最高化合价为+4)作原料,生产白色颜料二氧化钛的 主要步骤如下:
主要步骤如下:
 色胶体中加入3336b kg A和112c kg铁粉,鼓入足量空气搅拌,反应完成后,有大量Fe2O3附着在胶体粒子上以沉淀形式析出;过滤后,沉淀经高温灼烧得红色颜料。若所得滤液中溶质只有硫酸钠和硫酸铁,则理论上可生产红色颜料_______________________kg。
色胶体中加入3336b kg A和112c kg铁粉,鼓入足量空气搅拌,反应完成后,有大量Fe2O3附着在胶体粒子上以沉淀形式析出;过滤后,沉淀经高温灼烧得红色颜料。若所得滤液中溶质只有硫酸钠和硫酸铁,则理论上可生产红色颜料_______________________kg。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
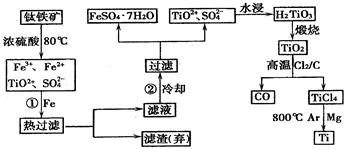
 2MgCl2+Ti , 在Ar气体中进行的目的是
2MgCl2+Ti , 在Ar气体中进行的目的是 查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com