
选考[化学——选修3:物质结构与性质] (15分)
锂—磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,可通过下列反应制备:
2Na3PO4+4CuSO4+2NH3·H2O=Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O
(1)写出基态Cu的第三能层的电子排布式 ,与Cu同周期的元素中,与铜原子最外层电子数相等的元素还有 (填元素符号),上述方程式中涉及到的N、O元素第一电离能由小到大的顺序为 。
(2)PO43-的空间构型是 。
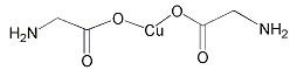
(3)氨基乙酸铜的分子结构如图,氮原子的杂化方式为 。
(4)在硫酸铜溶液中加入过量KCN,生成配合物[Cu(CN)4]2-,则CN-中含有的σ键与π键的数目之比为 。
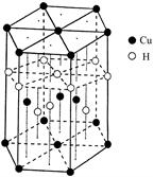
(5)Cu元素与H元素可形成一种红色化合物,其晶体结构单元如图所示。则该化合物的化学式为 。
(6)铜晶体为面心立方最密堆积,铜的原子半径为r pm,则晶体铜密度的计算式为 g/cm3。
(1)3s23p63d10 (1分) K Cr (2分) O<N (2分)
(2)正四面体(2分)
(3) sp3 (2分)
(4)1︰2 (2分)
(5)CuH (2分)
(6) (2分)
(2分)
【解析】
试题分析:(1)Cu原子序数为29,根据构造理论知,基态铜原子第三能层的电子排布式3s23p63d10 ;核外电子排布式为[Ar]3d104s1,最外层有1个电子,与Cu同周期的元素中,与铜原子最外层电子数相等的元素还有K Cr;同周期元素由左向右第一电离能逐渐增大,N、O元素第一电离能由小到大的顺序为O<N。(2)PO43—中P价层电子对数为4,P与4个O形成4个键,离子空间构型为正四面体。(3)氨基中N形成3个 键还有1对孤对电子,氮原子的杂化类型为sp3。(4)配合物[Cu(CN)4]2-中CN-含有碳氮三键,含有的σ键与π键的数目之比为1:2;(5)根据题给晶体结构单元知,该结构单元为正六棱柱,利用切割法分析,位于面上的原子为2个晶胞共用,对1个晶胞的贡献为1/2,位于顶点上的原子为6个晶胞共用,对1个晶胞的贡献为1/6,位于棱上的原子为3个晶胞共用,对1个晶胞的贡献为1/3,位于内部上的原子属于1个晶胞,对1个晶胞的贡献为1,则该晶胞中铜原子个数为12×1/6+2×1/2+4=6,氢原子个数为6×1/3+4=6,则该化合物的化学式为CuH;(6) 铜晶体为面心立方最密堆积,结构如图:
键还有1对孤对电子,氮原子的杂化类型为sp3。(4)配合物[Cu(CN)4]2-中CN-含有碳氮三键,含有的σ键与π键的数目之比为1:2;(5)根据题给晶体结构单元知,该结构单元为正六棱柱,利用切割法分析,位于面上的原子为2个晶胞共用,对1个晶胞的贡献为1/2,位于顶点上的原子为6个晶胞共用,对1个晶胞的贡献为1/6,位于棱上的原子为3个晶胞共用,对1个晶胞的贡献为1/3,位于内部上的原子属于1个晶胞,对1个晶胞的贡献为1,则该晶胞中铜原子个数为12×1/6+2×1/2+4=6,氢原子个数为6×1/3+4=6,则该化合物的化学式为CuH;(6) 铜晶体为面心立方最密堆积,结构如图:
 。在一个面心立方晶胞中,晶胞边长为a,铜原子的金属半径为r,根据简单的几何关系得:(4r)2 = a2 + a2,求出a,进一步得晶胞的密度的计算式见答案。
。在一个面心立方晶胞中,晶胞边长为a,铜原子的金属半径为r,根据简单的几何关系得:(4r)2 = a2 + a2,求出a,进一步得晶胞的密度的计算式见答案。
考点:考查核外电子排布、分子空间构型、杂化轨道、化学键和晶胞计算。


 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源:2014-2015湖南省高二上学期期中化学(文)试卷(解析版) 题型:选择题
2016年我国将实施新的《环境空气质量标准》.下列措施有利于改善大气质量、保护环境的是
A.大力发展火力发电
B.加高工厂的烟囱,使烟尘和废气远离地表
C.开发利用太阳能、氢能等新能源
D.焚烧城市垃圾不露天堆放
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省高三上学期第四次月考化学试卷(解析版) 题型:填空题
选做[有机化学]](10分)邻羟基桂皮酸(IV)是合成香精的重要原料,下列为合成邻羟基桂皮酸(IV)的路线之一
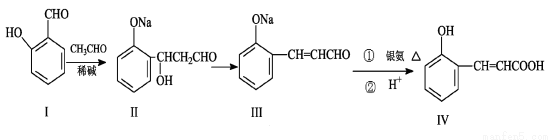
试回答:
(1)I中含氧官能团的名称 和 。
(2)II→III的反应类型 。
(3)① IV与乙醇和浓硫酸混合加热的化学方程式 。
② IV与过量NaOH溶液反应的化学方程式 。
(4)有机物X与IV互为同分异构体,且X有如下特点:
① 是苯的对位取代物, ② 能与NaHCO3反应放出气体 ,③能发生银镜反应。
请写出X的一种结构简式 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省高三上学期第四次月考化学试卷(解析版) 题型:选择题
今有甲、乙、丙、丁、戊5种物质,在一定条件下,它们能按下图方式进行转化:

其推断正确的是
选项 | 甲 | 乙 | 丙 | 丁 | 戊 |
A | NH3 | O2 | NO | H2O | NO2 |
B | Mg | CO2 | C | MgO | CO |
C | C | H2O | CO | H2 | CO2 |
D | FeBr2 | Cl2 | FeCl2 | Br2 | FeCl3 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年宁夏银川市高三上学期第三次月考理综试卷(解析版) 题型:选择题
某同学研究铝及其化合物的性质时设计了如下两个实验方案。
方案①:2.7 g Al X溶液
X溶液 Al(OH)3沉淀
Al(OH)3沉淀
方案②:2.7 g Al Y溶液
Y溶液 Al(OH)3沉淀
Al(OH)3沉淀
NaOH和HCl的浓度均是3 mol/L,如图是向X溶液和Y溶液中分别加入NaOH和HCl时产生沉淀的物质的量与加入盐酸和氢氧化钠溶液体积之间的关系,下列说法正确的是
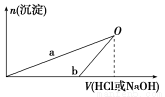
A.X溶液溶质为AlCl3,Y溶液溶质为NaAlO2
B.b曲线表示的是向X溶液中加入NaOH溶液
C.在O点时两方案中所得溶液浓度相等
D.a、b曲线表示的反应都是氧化还原反应
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高三上学期10月月考化学试卷(解析版) 题型:填空题
(12分)甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g) + 2H2(g)  CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应Ⅱ:CO2(g) + 3H2(g)  CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2
①下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K)。
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
由表中数据判断ΔH1 0 (填“>”、“=”或“<”)。
②某温度下,将2mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)= 0.2 mol/L,则CO的转化率为 ,此时的温度为 (从上表中选择)。
(2)已知在常温常压下:
①2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(l) ΔH1=-1451.6kJ/mol
②2CO (g)+ O2(g) = 2CO2(g) ΔH2 =-566.0kJ/mol
(3)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置:

①工作一段时间后,测得溶液的pH减小。请写出该电池的负极的电极反应式。
②用该电池电解(惰性电极)500mL某CuSO4溶液,电解一段时间后,为使电解质溶液恢复到原状态,需要向溶液中加入9.8g Cu(OH)2固体。则原CuSO4溶液的物质的量浓度为 mol/L(假设电解前后溶液体积不变)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省日照市高三12月校际联合检测化学试卷(解析版) 题型:选择题
下列有关说法正确的是
A.纯碱溶液加水稀释,溶液中所有离子浓度均减小
B.镀锡铁制品镀层受损后,铁制品比受损前更易被腐蚀
C.将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀
D.合成氨反应需使用催化剂,说明催化剂可以促进该平衡向生成氨的方向移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com