
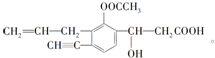
 +NaHCO3→
+NaHCO3→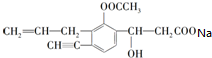 +CO2↑+H2O.
+CO2↑+H2O. 分析 (1)根据结构简式知,其分子式为C16H16O5;
(2)该分子中含有碳碳三键、碳碳双键、酯基、醇羟基、羧基;
(3)该物质中的羧基能和碳酸氢钠反应生成二氧化碳、水和羧酸钠.
解答 解:(1)根据结构简式知,其分子式为C16H16O5,故答案为:C16H16O5;
(2)根据图片知,该分子中含有碳碳三键、碳碳双键、酯基、醇羟基、羧基,其含氧官能团是酯基、羟基、羧基,
故答案为:酯基、羟基和羧基;
(3)该物质中的羧基能和碳酸氢钠反应生成二氧化碳、水和羧酸钠,反应方程式为 +NaHCO3→
+NaHCO3→ +CO2↑+H2O,
+CO2↑+H2O,
故答案为: +NaHCO3→
+NaHCO3→ +CO2↑+H2O.
+CO2↑+H2O.
点评 本题考查有机物结构和性质,为高考高频点,侧重考查碳碳不饱和键、酯基、醇羟基和羧基,明确官能团及其性质的关系即可解答,题目难度不大.


科目:高中化学 来源: 题型:填空题
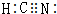 ,HCN中C元素的化合价为+2价.
,HCN中C元素的化合价为+2价.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
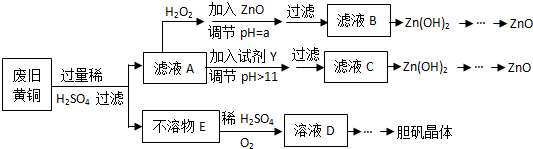
| Fe3+ | Fe2+ | Zn2+ | |
| 开始沉淀的pH | 1.1 | 5.8 | 5.9 |
| 沉淀完全的pH | 3.0 | 8.8 | 8.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Cl2能与金属活动顺序表中大多数金属反应 | |
| B. | 待测溶液中加入氯化钡溶液有白色沉淀生成,再加稀硝酸,沉淀不消失,一定有硫酸根离子 | |
| C. | 在用AgNO3溶液检验Cl-时,一般先在被检测的溶液中滴入少量的稀硝酸使其酸化,以排除干扰离子 | |
| D. | 硅是应用广泛的半导体材料,常温下化学性质不活泼,是光导纤维的主要成分 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碘乙烷水解实验后,取水解液,加入AgNO3溶液,检验卤素离子 | |
| B. | 碘乙烷水解实验后,取水解液,加入KMnO4(H+)溶液,检验产物乙醇 | |
| C. | 碘乙烷消去实验后,将气体导入KMnO4(H+)溶液,检验产物乙烯 | |
| D. | 碘乙烷消去实验后,将气体导入Br2(CCl4)溶液,检验产物乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化氮中混有一氧化氮杂质,可通入氧气将一氧化氮转化为二氧化氮 | |
| B. | 过量的铜与浓硝酸反应一定有一氧化氮生成 | |
| C. | Fe与S混合加热生成FeS2 | |
| D. | 工业上利用氨气制硝酸属于人工固氮 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. |  | C. |  | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 2min | 4min | 6min | 8min | ′′′ | |
| CO | 0.07 | 0.06 | 0.04 | 0.05 | ′′′ |
| H2 | x | 0.12 | 0.12 | 0.2 | ′′′ |
| CH2OH | 0.03 | 0.04 | 0.04 | 0.05 | ′′′ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com