

分析 (1)反应Ni(s)+4CO(g) Ni(CO)4(g)为化合反应,大多数的化合反应为放热反应,据此判断;
Ni(CO)4(g)为化合反应,大多数的化合反应为放热反应,据此判断;
(2)根据盖斯定律计算该反应的反应热;
(3)设5min末消耗COamol/L,
则:CO(g)+H2O?(g)CO2(g)+H2(g),
初始量(mol/L):3 3 0 0
变化量(mol/L):a a a a
5min末(mol/L):3-a 3-a a a
K=$\frac{a×a}{(3-a).(3-a)}$=9.0,解得a=2.25,
CO转化率=$\frac{2.25mol/L}{3mol/L}×100%$;
(4)①该燃料电池中,负极上CO失电子和碳酸根离子反应生成二氧化碳;
②燃料电池中通入氧气的电极是正极,电解精炼粗铜时,电解池阳极与原电池正极相连;
③C电极是阴极,阴极上铜离子得电子生成Cu,根据转移电子守恒计算生成铜质量.
解答 解:(1)反应Ni(s)+4CO(g) Ni(CO)4(g)为化合反应,大多数的化合反应为放热反应,放热反应的△H<0,故答案为:<;
Ni(CO)4(g)为化合反应,大多数的化合反应为放热反应,放热反应的△H<0,故答案为:<;
(2)①C(s)+O2(g)═CO2(g)△H1=-393.5kJ•mol-1
②CO2(g)+C(s)═2CO(g)△H2=+172.5kJ•mol-1
③S(s)+O2(g)═SO2(g)△H3=-296.0kJ•mol-1
根据盖斯定律,将方程式①-②-③得反应2CO+SO2=S+2CO2,则焓变=△H1-△H2-△H3=(-393.5kJ•mol-1
)-(+172.5kJ•mol-1)-(-296.0kJ•mol-1)=-270 kJ•mol-1,
故答案为:2CO(g)+SO2(g)=S(s)+2CO2(g)△H=-270kJ•mol-1 ;
(3)设5min末消耗COamol/L,
则:CO(g)+H2O(g)?CO2(g)+H2(g),
初始量(mol/L):3 3 0 0
变化量(mol/L):a a a a
5min末(mol/L):3-a 3-a a a
K=$\frac{a×a}{(3-a).(3-a)}$=9.0,解得a=2.25,
CO转化率=$\frac{2.25mol/L}{3mol/L}×100%$=75%,故答案为:75%;
(4)①CO具有还原性在负极上发生氧化反应生成CO2,电极反应式为:CO-2e-+CO32-═2CO2,
故答案为:CO-2e-+CO32-═2CO2;
②因A为负极,B为正极,粗铜精炼时,粗铜作阳极,与电源的正极相连,故选:D;
③由CO-2e-+CO32-=2CO2可知,当消耗标准状况下2.24LCO时,反应转移0.2mol电子,则C极上析出质量=$\frac{0.2mol}{2}×64g/mol$=6.4g,故答案为:6.4g.
点评 本题考查盖斯定律的应用、原电池和电解池的工作原理、化学平衡计算等知识点,综合性较强,侧重考查学生分析计算能力,难点是电极反应式的书写,要根据电解质确定电极反应式书写方式,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 将一定量的A、B、C三种物质(都是气体)放入固定体积为10L的密闭容器中,一定条件下发生反应,一段时间内测得各物质的物质的量变化如图所示.
将一定量的A、B、C三种物质(都是气体)放入固定体积为10L的密闭容器中,一定条件下发生反应,一段时间内测得各物质的物质的量变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ①③⑥ | C. | ②④⑤ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在2L密闭容器内,800℃时反应2NO(g)+O2(g)=2NO2(g)体系中,n(NO)随时间的变化如下表:
在2L密闭容器内,800℃时反应2NO(g)+O2(g)=2NO2(g)体系中,n(NO)随时间的变化如下表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
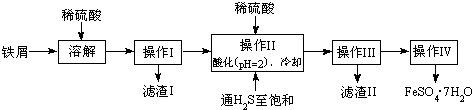
| 25℃时 | pH值 |
| 饱和H2S溶液 | 3.9 |
| SnS沉淀完全 | 1.6 |
| FeS开始沉淀 | 3.0 |
| FeS沉淀完全 | 5.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 日常生活中无水乙醇常用于杀菌消毒 | |
| B. | 用乙醇作萃取剂可以将碘从碘水中萃取出来 | |
| C. | 乙醇、乙烷和苯都可以与钠反应生成氢气 | |
| D. | 乙醇是一种可再生能源 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com