
下列有关热化学方程式的表示及说法正确的是:
A.已知2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ/mol,则氢气
的燃烧热为241.8 kJ/mol
B.25 ℃、101 kPa时,1 mol S和2 mol S的燃烧热不相等
C.含20.0 g NaOH的稀溶液与稀硫酸完全中和,放出28.7 kJ的热
量,则表示该反应中和热的热化学方程式为:NaOH(aq)+
H2SO4(aq)=Na2SO4(aq)+H2O(l) ΔH=-57.4 kJ/mol
D.已知I2(g)+H2(g)===2HI(g) ΔH1,I2(s)+H2(g)===2HI(g) ΔH2,
则ΔH1>ΔH2
科目:高中化学 来源: 题型:
化合物HIn在水溶液中因存在以下电离平衡,故可用作酸碱指示剂
HIn(红色溶液)  H+(溶液)+ In-(黄色溶液)
H+(溶液)+ In-(黄色溶液)
浓度为0.02 mol·L-1的下列各溶液: ①盐酸 ②石灰水 ③NaCl溶液 ④NaHSO4溶液 ⑤NaHCO3溶液 ⑥氨水,⑦AlCl3溶液其中能使指示剂显红色的是
A.②⑤⑥ B.①④ ⑤ C.①④⑦ D.① ④⑤⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
检验SO2中是否混有CO2气体,可采用的方法是( )
A.通过澄清的石灰水 B.通过NaOH溶液,再通过澄清石灰水
C.先通过酸性KMnO4溶液,再通过澄清石灰水
D.先通过NaHCO3溶液,再通过澄清石灰水
查看答案和解析>>
科目:高中化学 来源: 题型:
FeCl3是一种用途比较广泛的盐。
(1)印刷电路板是由高分子材料和铜箔复合而成。刻制印刷电路时,要用FeCl3溶液作为“腐蚀液”,生成CuCl2和FeCl2。请写出反应的离子方程式 。
(2)FeCl3在天然水中可生成氢氧化铁胶体,其沉降水中悬浮物的速度高于铝盐(如硫酸铝等),是城市污水及工业废水处理的高效絮凝剂。实验室制取氢氧化铁胶体的方法是 (填字母序号)。
A. 将饱和的FeCl3溶液滴入沸水中,生成棕黄色液体即可。
B. 在FeCl3溶液中加入足量的NaOH溶液
C. 将饱和的FeCl3溶液滴入沸水,并继续煮沸至生成红褐色液体
D. 将饱和的FeCl3溶液滴入沸水,并继续煮沸至生成红褐色沉淀
证明此胶体已经制成的最简单方法为 。
(3)FeCl3可使湿润的淀粉碘化钾试纸变蓝,化学方程式如下:2FeCl3 + 2KI = 2FeCl2 + I2 +2KI
在上式上用双线桥法标出该反应电子转移的方向和数目。向反应后的溶液中加入CCl4溶液,振荡、静置后会发现下层液体的颜色为 色,再将混合液倒入 (填仪器名称)中,将两层液体分离。
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,在固定容积的密闭容器中,能表示反应X(g)+2Y(g)  2Z(g)一定达到化学平衡状态的是:
2Z(g)一定达到化学平衡状态的是:
①X、Y、Z的物质的量之比为1∶2∶2
②X、Y、Z的浓度不再发生变化
③容器中气体的压强不再发生变化
④单位时间内生成n mol Z,同时生成n mol X
A.①② B.①④
C.②③ D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
下列常数表达式不正确的是:
A.2SO2(g)+O2(g)  2SO3(g)的化学平衡常数表达式为
2SO3(g)的化学平衡常数表达式为
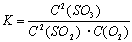
B.NH3·H2O的电离平衡常数表达式为
C. 溶度积常数表达式为
溶度积常数表达式为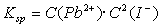
D. SO2(g)+ O2(g)  SO3(g)的化学平衡常数表达式为
SO3(g)的化学平衡常数表达式为
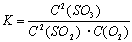
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化合物:①HCl ②NaOH ③CH3COOH ④NH3·H2O ⑤CH3COONa ⑥NH4Cl ⑦C2H5OH ⑧SO2
(1)属于弱电解质的是 ,溶液呈碱性的有 (填序号)。
(2)常温下0.01 mol/L NaOH溶液的pH= ;pH=11的CH3COONa溶液中由水电离产生的c(OH-) = 。
mol/L NaOH溶液的pH= ;pH=11的CH3COONa溶液中由水电离产生的c(OH-) = 。
(3)用离子方程式表示CH3COONa溶液呈碱性的原因 ,其溶液中离子浓度按由大到小的顺序为 。
 (4)常温下,向100 mL 0.01 mol·L-1HA溶液逐滴加入0.02 mol·L-1MOH 溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。回答下列问题:
(4)常温下,向100 mL 0.01 mol·L-1HA溶液逐滴加入0.02 mol·L-1MOH 溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。回答下列问题:
①由图中信息可知HA为_______酸
(填“强”或“弱”)。
②在滴加过程中,水的电离程度的变化是先 后 (填“增大”、“减小”或“不变”)
③K点对应的溶液中, c(M+)+c(MOH)= mol·L-1。
(5)在25 ℃下,向浓度均为0.01 mol·L-1的FeCl3和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),当测得溶液pH=11时,则此温度下残留在溶液中的c(Cu2+):c(Fe3+)
= 。
(已知25℃时Ksp[Fe(OH)3]=4.0×10-38, Ksp[Cu(OH)2]=2.2×10-20)
(6)25℃时,将bmol NH4NO3溶于水,向该溶液滴加aL氨水后溶液呈中性,则所滴加氨水的浓度为_______mol·L-1。(NH3·H2O的电离平衡常数取Kb = 2×10-5 mol·L-1)
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:

下列叙述正确的是( )
A.试剂X可以是氢氧化钠溶液,也可以是盐酸
B.反应①过滤后所得沉淀为氢氧化铁
C.反应②通入的过量Y是CO2气体
D.图中所示的转化反应①②都是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
A.蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有吸水性
B.硫粉在过量的氧气中燃烧可以生成SO3
C.将少量SO2通入BaCl2溶液能生成白色沉淀
D.将浓盐酸、浓硝酸和浓硫酸分别露置在空气中,溶质的物质的量浓度都降低
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com