
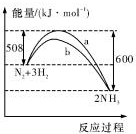
| A. | 该反应的热化学方程式为:2NH3?N2+3H2△H=-92kJ.mol-1 | |
| B. | 生成物的能量之和比反应物的能量之和高 92 kJ | |
| C. | a曲线是未加入催化剂时的能量变化曲线 | |
| D. | 加入催化剂可增加正反应速率,减小逆反应速率 |
分析 A、热化学方程式需要标注物质聚集状态和对应焓变,选项中是反应的逆反应;
B、依据图象分析,反应物能量高于生成物;
C、催化剂降低反应的活化能,改变反应速率不改变平衡;
D、催化剂同等程度改变反应正逆反应速率.
解答 解:A、该反应的热化学方程式为:N2 (g)+3H2(g)?2NH3 (g)△H=-92KJ/mol,故A错误;
B、依据图象可知,反应物能量之和比生成物的能量之和高92KJ,故B错误;
C、催化剂降低反应的活化能,改变反应速率不改变平衡,a曲线是未加入催化剂时的能量变化曲线,b曲线是加入催化剂时的能量变化曲线,故C正确;
D、加入催化剂可同等程度改变反应正逆反应速率,故D错误;
故选C.
点评 本题考查了阿伏伽德罗常数的应用,主要是热化学方程式 书写,图象分析判断,反应能量变化,催化剂作用分析,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 草酸稀溶液加水稀释,溶液中所有离子浓度均减小 | |
| B. | NaHC2O4溶液中有:2c(Na+)=c(H2C2O4)+c(HC2O4-)+c(C2O42-) | |
| C. | pH=3的草酸与pH=12的NaOH溶液混合至中性时,溶液中有:c(Na+)=c(HC2O4-)+2c(C2O42-) | |
| D. | 等浓度的草酸和碳酸相比,溶液中由水电离出来的c(H+)前者更多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在Na2S溶液中:c(Na+)=c(HS-)+c(S2-) | |
| B. | 乙烯的燃烧热为akJ•mol-1(a>0),则乙烯燃烧的热化学方程式可表示为C2H4(g)+3O2(g)=2CO2(g)+2H2O(g)△H=-akJ•mol-1 | |
| C. | 钢铁发生吸氧腐蚀的正极反应式为O2+4e-+2H2O=4OH- | |
| D. | 从酸化的海带灰浸出液中提取碘:2I-+H2O2=I2+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
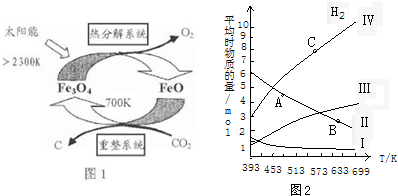
 -CH3(g)+11H2△H=kJ•mol-1.
-CH3(g)+11H2△H=kJ•mol-1.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
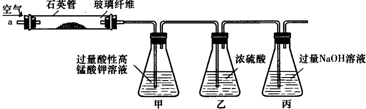
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3$→_{催化剂}^{O_{2}}$NO$\stackrel{O_{2}}{→}$ NO2$\stackrel{H_{2}O}{→}$HNO3 | |
| B. | 浓缩海水$\stackrel{Cl_{2}}{→}$Br2$\stackrel{SO_{2}}{→}$ HBr$\stackrel{Cl_{2}}{→}$ Br2 | |
| C. | 饱和食盐水$\stackrel{电解}{→}$Cl2$\stackrel{Ca(OH)_{2}}{→}$ 漂白粉 | |
| D. | H2和Cl2混合气体$\stackrel{光照}{→}$HCl气体$\stackrel{水}{→}$ 盐酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com