
| △c |
| △t |
| 0.15mol/L |
| 0.45mol∥L |
| 0.30mol/L |
| 10min |
| (0.2+0.30+0.30)mol/L×10L |
| 5.0mol+4.5mol |
| 0.30mol/L×10L |
| (0.2mol/L+0.3mol/L+0.3mol/L)×10L |
| c2(SO3) |
| c2(SO2)c(O2) |
| (0.3mol/L)2 |
| (0.2mol/L)2×0.3mol/L |


 优等生题库系列答案
优等生题库系列答案科目:高中化学 来源: 题型:
| A、含有弱酸根盐的水溶液一定显碱性 |
| B、室温下,pH相同、体积相同的氨水和氢氧化钠两种溶液分别加水稀释2倍后,两溶液的pH均减小,其中,稀释后的氢氧化钠的pH比氨水的小 |
| C、室温时,0.01 mol?L-1醋酸溶液的pH=2 |
| D、室温时,0.01 mol?L-1醋酸溶液中加入等体积等浓度的NaOH溶液后,所得溶液的pH=7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、红棕色的NO2,加压后颜色先变深后变浅 |
| B、工业上合成NH3反应使用催化剂 |
| C、实验室可以采用排饱和食盐水收集Cl2 |
| D、由H2、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、A、C、D的物质的量浓度相等 |
| B、混合气体的密度不再改变 |
| C、气体的总物质的量不再改变 |
| D、v(B)=2v(C) |
查看答案和解析>>
科目:高中化学 来源: 题型:
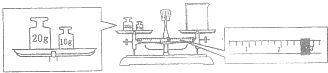
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
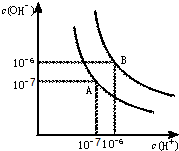 水的电离平衡曲线如图所示.
水的电离平衡曲线如图所示. 查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com