
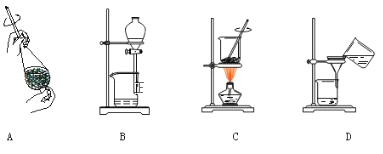
【题目】实验室制取乙酸乙酯,如图所示实验装置:

请回答下列问题:
(1)能完成本实验的装置是 __________________(从甲、乙、丙中选填)
(2)试管B中装入的液体为 ______________。
(3)制取乙酸乙酯时加入试剂顺序为_____________________,发生反应的化学方程式为 __________________________________________。
(4)从制备乙酸乙酯所得的混合物中分离、提纯乙酸乙酯时,需要经过多步操作,下列图示的操作中,肯定需要的化学操作是___________(选填答案编号)。
(5)用30g乙酸和40g乙醇反应,可以得到37.4g乙酸乙酯,则该实验的产率(产率指的是某种生成物的实际产量与理论产量的比值)是 ____________。
【答案】乙、丙 饱和Na2CO3溶液 将浓H2SO4加入乙醇中,边加边振荡,最后加入乙酸(按乙醇、浓硫酸、乙酸顺序即可) CH3COOH+HOCH2CH3 ![]() CH3COOCH2CH3+H2O A、B 85%
CH3COOCH2CH3+H2O A、B 85%
【解析】
(1)甲中导管在液面下可发生倒吸,而乙和丙均可防止倒吸,乙和丙可顺利完成实验,故答案为:乙、丙;
(2)乙酸乙酯在饱和碳酸钠溶液中溶解度较小,且可除去乙酸、乙醇,试管B中装入的液体为饱和Na2CO3溶液;
(3)加入药品时应注意防止酸液飞溅,可将浓H2SO4加入乙醇中,边加边振荡,最后加入乙酸,催化条件下,乙酸、乙醇发生酯化反应生成乙酸乙酯,方程式为CH3COOH+HOCH2CH3 ![]() CH3COOCH2CH3+H2O;
CH3COOCH2CH3+H2O;
(4)从混合物中分离出乙酸乙酯,要用萃取、分液的方法,故选用A、B两装置,故答案为:A、B;
(5)30g乙酸的物质的量为![]() =0.5mol,40g乙醇的物质的量为
=0.5mol,40g乙醇的物质的量为![]() mol=0.87mol,根据反应方程式CH3COOH+HOCH2CH3
mol=0.87mol,根据反应方程式CH3COOH+HOCH2CH3 ![]() CH3COOCH2CH3+H2O,可知乙醇过量,
CH3COOCH2CH3+H2O,可知乙醇过量,
设乙酸乙酯的理论产量为m,则
CH3COOH+HOCH2CH3 ![]() CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
60 88
30g m
故m=![]() =44g,
=44g,
则产率为![]() ×100%=85%。
×100%=85%。


 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:
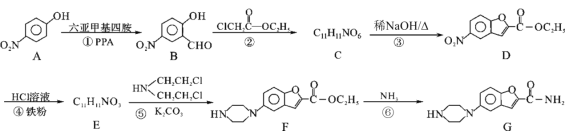
【题目】维拉佐酮是临床上使用广泛的抗抑郁药,其关键中间体G的合成路线如下:
已知:![]()
请回答下列问题:
(1)A中含氧官能团的名称______________。
(2)反应④的反应类型是:______________。
(3)下列有关说法错误的是______________。
a.B遇FeCl3溶液显紫色且能发生银镜反应
b.A、B两种物质不可用核磁共振氢谱或红外光谱区别
c.C能发生取代、加成、氧化、还原反应
d.E能与NaOH反应,不能与盐酸反应
(4)写出E与NH(CH2CH2Cl)2反应得到F的化学方程式:____________________;⑤中加入K2CO3的作用是______________________________________________。
(5)B的同分异构体中,满足下列条件的有_____种;
①含有苯环;②能与NaOH溶液反应
写出其中一种核磁共振氢谱为三组峰的结构简式:________________________。
(6)已知: RBr ![]() RCN
RCN ![]() RCOOH,请以甲苯、乙醇等为原料制备
RCOOH,请以甲苯、乙醇等为原料制备![]() ,写出相应的合成路线流程图(无机试剂任用,合成路线流程图示例见题干)______________
,写出相应的合成路线流程图(无机试剂任用,合成路线流程图示例见题干)______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】双酚A( )是一种重要的化工原料,它的一种合成路线如下图所示:
)是一种重要的化工原料,它的一种合成路线如下图所示:
丙烯![]()
![]()
![]()
![]()
![]()
![]()
![]() 双酚A
双酚A
下列说法正确的是( )
A. 1 mol 双酚A最多可与2 mol Br2反应
B. G物质是乙醛的同系物
C. E物质的名称是1-溴丙烷
D. 反应③的化学方程式是![]() +O2
+O2![]() 2CH3COCH3+2H2O
2CH3COCH3+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物M的结构简式如图所示,下列叙述正确的是

A.其分子式为C12H12O5
B.M中含有2种含氧官能团
C.M能够发生加成、取代和加聚反应
D.1 mol M和足量的NaOH溶液反应,可以消耗2 mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
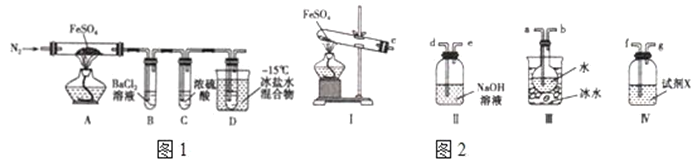
【题目】工业上常通过高温分解FeSO4的方法制备Fe2O3,为检验FeSO4高温分解的产物,并进行有关探究实验,回答下列问题:高温分解FeSO4,利用如图1所示的实验装置进行实验.
已知:①SO2熔点为﹣72℃,沸点为﹣10℃;
②SO3熔点为﹣16.8℃,沸点为44.8℃。
(1)连接装置,检验气密性良好,放入药品,通入一段时间N2然后加热,通入N2的目的是__________________________。
(2)隔绝空气加热至650℃,看到B中有白色沉淀,D试管中有无色液体,硬质玻璃管中的固体变为______,同时有两种无色气体生成,写出该反应的化学方程式_________________________________。
(3)反应完毕后,停止加热冷却后,取硬质玻璃管中固体,加盐酸,反应的离子方程式是___,将反应后所得溶液滴入D试管中,溶液变为浅绿色,该反应的离子方程式是__________________________。
(4)有人认为该实验装置存在一定的缺陷,再增加一个装置即可弥补该缺陷,请指出添加的仪器位置及药品________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列方法均可制得氯气:
①MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
②KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O
③2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O
若要制得相同质量的氯气,①②③反应中电子转移数目之比为( )
A. 6∶5∶6B. 1∶3∶5C. 15∶5∶3D. 1∶6∶10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有五种短周期元素,它们的结构、性质等信息如下表所述:
元素 | 结构、性质等信息 |
A | 是短周期中(除稀有气体外)原子半径最大的元素,该元素的某种合金是原子反应堆的导热剂 |
B | B与A同周期,其最高价氧化物的水化物呈两性 |
C | 元素的气态氢化物极易溶于水,可用作制冷剂 |
D | 是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂 |
E | L层上有2对成对电子 |
请根据表中信息填空:
(1)A原子的核外电子排布式为___________。
(2)B元素在周期表中的位置:__________________;离子半径:B___ A(填“大于”或“小于”)
(3)C原子的价电子排布图是___________,其原子核外有__________个未成对电子,能量最高的电子为___________轨道上的电子,其轨道呈___________形。
(4)D原子的电子排布式为___________。D-的结构示意图是________________
(5)C、E元素的第一电离能的大小关系是___________(用元素符号表示)。
(6)已知CD3分子中D元素为+1价,则C、D的电负性大小关系是________________(用元素符号表示),CD3与水反应后的产物是__________和__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸工业尾气中二氧化硫的含量超过0.05%(体积分数)时需经处理后才能排放。某校兴趣小组欲测定硫酸工业尾气中二氧化硫的含量,采用以下方案:
甲方案:如图所示,图中气体流量计B用于准确测量通过尾气的体积。将尾气通入一定体积已知浓度的碘水中测定SO2的含量。当洗气瓶C中溶液蓝色消失时,立即关闭活塞A。

(1)碘水吸收二氧化硫的离子方程式为___。
(2)洗气瓶C中的溶液可以用其他试剂替代,请你举出一种:___。
(3)洗气瓶C溶液蓝色消失后,没有及时关闭活塞A,测得的SO2含量___(填“偏高”、“偏低”或“无影响”)。
乙方案:实验步骤如图流程图所示:
![]()
(4)写出步骤①中反应的化学方程式___。
(5)写出步骤②中反应的离子方程式___。
(6)该尾气中二氧化硫的体积分数为___(气体体积已换算成标准状况,用含有V、m的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,H2R及其钠盐的溶液中,H2R、HR-、R2-分别在三者中所占的物质的量分数(α)随溶液pH变化关系如下图所示,下列叙述错误的是
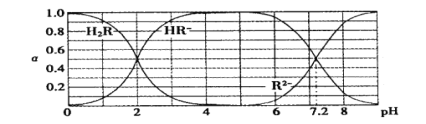
A.H2R是二元弱酸,其Ka1=1×10-2
B.当溶液恰好呈中性时,c( Na + )=2c ( R2- ) + c( HR- )
C.NaHR在溶液中水解倾向大于电离倾向
D.含Na2R与NaHR各0.1 mol的混合溶液的pH=7.2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com