

| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 9.2 |
分析 镍催化剂中含Ni 64.0%,Al 24.3%、Fe 1.4%,其余为SiO2和有机物,废催化剂中加入碱液,Al、SiO2分别和碱液发生反应2Al+2OH-+2H2O═2AlO2-+3H2↑、SiO2+2OH-=SiO32-+H2O,然后过滤,滤液A中含有NaAlO2、Na2SiO3,
其余为滤渣a,滤渣a中加入硫酸,金属Fe变为Fe2+,Ni变为Ni2+,过滤后,其余为滤渣b,滤液B中含有FeSO4、NiSO4,向滤液B中加入双氧水的目的是把Fe2+氧化为Fe3+,以便与调节pH使其生成沉淀除去,即溶液C中含有Fe3+、Ni2+等,调节pH=6,得到沉淀为Fe(OH)3,过滤得到滤渣c为Fe(OH)3,得到滤液D为含有Ni2+的溶液,然后继续调节pH值,最后蒸发结晶即可得到目标产物,据此分析解答.
解答 解:镍催化剂中含Ni 64.0%,Al 24.3%、Fe 1.4%,其余为SiO2和有机物,废催化剂中加入碱液,Al、SiO2分别和碱液发生反应2Al+2OH-+2H2O═2 AlO2-+3H2↑、SiO2+2OH-=SiO32-+H2O,然后过滤,滤液A中含有NaAlO2、Na2SiO3,
其余为滤渣a,滤渣a中加入硫酸,金属Fe变为Fe2+,Ni变为Ni2+,过滤后,其余为滤渣b,滤液B中含有FeSO4、NiSO4,向滤液B中加入双氧水的目的是把Fe2+氧化为Fe3+,以便与调节pH使其生成沉淀除去,即溶液C中含有Fe3+、Ni2+等,调节pH=6,得到沉淀为Fe(OH)3,过滤得到滤渣c为Fe(OH)3,得到滤液D为含有Ni2+的溶液,然后继续调节pH值,最后蒸发结晶即可得到目标产物,
(1)通过以上分析知,Al、SiO2分别和碱液反应生成偏铝酸盐、硅酸盐,且NaOH溶液过量,所以滤液A中存在的阴离子主要是AlO2-、SiO32-、OH-,故答案为:AlO2-、SiO32-、OH-;
(2)硫酸浸取滤渣a后,Ni、Fe都能和稀硫酸反应生成金属阳离子,所以所得滤液B中可能含有的金属离子是Fe2+、Ni2+,故答案为:Fe2+、Ni2+;
(3)滤液B中含有Fe2+、Ni2+,双氧水具有强氧化性,能氧化还原性离子,所以加入H2O2的目的是将Fe2+氧化成Fe3+,有利于分离;操作X的名称是蒸发浓缩、冷却结晶;
故答案为:将Fe2+氧化成Fe3+,有利于分离;蒸发浓缩、冷却结晶;
(4)阳极电极反应方程式为:Ni(OH)2+OH--e-=NiOOH+H2O;放电为原电池,负极失去电子,发生氧化反应,电极反应方程式为:MHx+xOH--xe-=M++xH2O,故答案为:Ni(OH)2+OH--e-=NiOOH+H2O;MHx+xOH--xe-=M++xH2O.
点评 本题以化学工艺流程为载体考查物质分离和提纯,涉及基本操作、物质性质、物质分离和提纯、原电池和电解池原理等知识点,明确流程图中各个过程发生的反应、基本操作方法及物质性质是解本题关键,题目难度中等.


 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 2Na+2NH3═2NaNH2+H2↑ | B. | 2NH3+3CuO═3Cu+N2+3H2O | ||
| C. | NH3+HNO3═NH4NO3 | D. | 3SiH4+4NH3═Si3N4+12H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性 | |
| B. | 浓硫酸和浓盐酸混合可制氯化氢,说明浓硫酸是一种难挥发性的酸 | |
| C. | 常温下,浓硫酸可以用铝罐储存,说明铝与浓硫酸不反应 | |
| D. | 在化学反应Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+H2O中浓H2SO4只表现氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
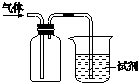
| A. | 该装置可用于收集NO2,试剂为水,用于吸收多余的NO2 | |
| B. | 若试剂是紫色石蕊试液,通入Cl2,溶液先变红后褪色,则氯气有漂白性 | |
| C. | 该装置可用于收集NH3,试剂为水,用于吸收多余的NH3 | |
| D. | 若试剂是酸性KMnO4溶液,通入SO2,溶液褪色,则得出SO2有还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
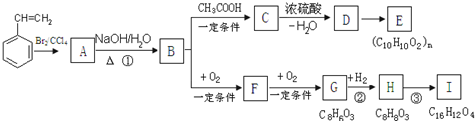
 .
.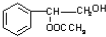 或
或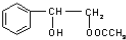 .
.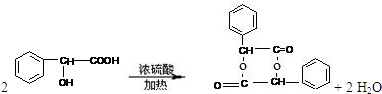 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 熔点:Na>Al | B. | 热稳定性NaHCO3>Na2CO3 | ||
| C. | 酸性:H2CO3>H2SiO3 | D. | 氧化性Br2>Cl2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com