
【题目】已知A、B、C、D和E五种分子所含原子的数目依次为1、2、3、4和6,且都含有18个电子,又知B、C和D是由两种元素的原子组成,且D分子中两种原子个数比为1∶1。
请回答:
(1)组成A分子的原子的核外电子排布图是 ;
(2)B和C的分子式分别是 和 ;C分子的空间构型为 形,该分子属于 分子(填“极性”或“非极性”);
(3)向D的稀溶液中加入少量氯化铁溶液现象是 ,该反应的化学方程式为 ;
(4)若将1 mol E在氧气中完全燃烧,只生成1 mol CO2和2 mol H2O,则E的分子式是 。
 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:
【题目】锂一铜空气燃料电池容量高、成本低,具有广阔的发展前景。该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为2Li+Cu2O+H2O==2Cu+2Li++2OH-,下列说法不正确的是

A. 放电时,正极的电极反应式为Cu2O+H2O+2e-=2OH-+2Cu
B. 放电时,电子透过固体电解质向Li极移动
C. 通空气时,铜电极被腐蚀,表面产生Cu2O
D. 整个反应过程中,氧化剂为O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金华市金东区环保部门为了使农村生活垃圾得到合理利用,在全国率先实施了生活垃圾分类投放的办法。其中塑料袋、废纸、旧橡胶制品等属于
A. 无机物 B. 有机物 C. 盐类 D. 非金属单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在一个2L的密闭容器中,X、Y、Z三种气体物质的物质的量随时间的变化曲线如图所示.下列说法不正确的是( )

A. 该反应的化学方程式为3X+Y![]() 2Z
2Z
B. 容器内混合气体的平均摩尔质量保持不变表明该反应一定达到平衡状态
C. 平衡时,体系的压强是开始时的1.8倍
D. 平衡时,Y的体积分数为50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一瓶物质甲和乙的混合物,已知甲和乙的某些性质如下:
物质 | 分子式 | 熔点/℃ | 沸点/℃ | 密度/(g/cm3) | 水中溶解性 |
甲 | C3H6O2 | -98 | 57.5 | 0.93 | 可溶 |
乙 | C4H8O2 | -84 | 77 | 0.90 | 可溶 |
据此,将甲和乙互相分离的最佳方法是( )
A.萃取法 B.升华法 C.蒸馏法 D.分液法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.淀粉可以制得葡萄糖和酒精
B.铝合金的熔点和硬度均高于纯铝
C.玻璃、塑料、金属、纸类均是可回收的物品
D.硬化油不易被空气氧化而便于储存和运输
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求完成下列问题:
(1)某元素原子共有3个价电子,其中一个价电子位于第三能层d轨道,试回答:
该元素核外价电子排布图_____________,电子排布式_____________________。该元素的原子序数为______,该元素是______元素(填“金属”或“非金属”),形成的单质为______晶体。
(2)指出配合物K3[Co(CN)6]中的中心离子、配位体及其配位数:_________、__________、________。
(3)下列分子中若有手性原子,请用“*”标出其手性碳原子。_____
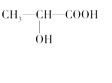
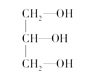
(4)在下列物质①CO2、②NH3、③CCl4、④BF3、⑤H2O、⑥SO2、⑦SO3、⑧、PCl3中,属于非极性分子的是(填番号)________________。
(5)试比较下列含氧酸的酸性强弱(填“>”、“<”或“=”):H2SO4________H2SO3; HClO3________HClO4; H3PO4________H3PO3。
(6)根据价层电子对互斥理论判断下列问题:
①NH3中心原子的杂化方式为______杂化,VSEPR构型为__________,分子的立体构型为__________________。
②BF3分子中,中心原子的杂化方式为________杂化,分子的立体构型为____________。
(7)H2O的沸点(100℃)比H2S的沸点(-61℃)高,这是由于_________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语正确的是
A. NaHCO3的水解方程式:HCO3-+H2O![]() H3O++CO32-
H3O++CO32-
B. 醋酸铵的电离:CH3COONH4![]() CH3COO-+NH4+
CH3COO-+NH4+
C. 氯化银的溶解平衡表达式:AgCl(s) ![]() Ag+(aq)+Cl-(aq)
Ag+(aq)+Cl-(aq)
D. 汽车尾气净化反应2NO+2CO=2CO2+N2能够自发进行,则该反应的△H>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知海水中溴元素主要以Br-形式存在,工业上从海水中提取溴的流程如下:

资料:溴单质容易挥发。
(1)写出“氧化”时的离子方程式_______。
(2)写出第1步“吸收”时的离子方程式________________,该反应体现了SO2的____性。
(3)得到的“含Br2溶液”通过以下不同操作,都可得到溴单质:
① 直接蒸馏得到溴单质,该操作利用的是溴的何种性质:___________;
② 加入四氯化碳萃取,将得到的溴的四氯化碳溶液蒸馏得到溴单质。可以用四氯化碳对溴溶液进行萃取利用的是溴的何种性质:_______________。
(4)对虚线框中的流程进行整体分析,完整说明该流程中所有操作的目的是___________。
(5)工业可用Na2CO3溶液代替二氧化硫的水溶液吸收Br2,完成下列化学反应方程式:
___Br2+___Na2CO3=___NaBrO3+____CO2+__ ______
若有480g溴完全反应,转移电子的物质的量为__________ mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com