
向5 mL NaCl溶液中滴入一滴AgNO3溶液,出现白色沉淀,继续滴加一滴KI溶液并振荡,沉淀变为黄色,再滴入一滴Na2S溶液并振荡,沉淀又变成黑色,根据上述变化过程,分析此三种沉淀物的溶解度关系为( )
A.AgCl=AgI=Ag2S B.AgCl<AgI<Ag2S
C.AgCl>AgI>Ag2S D.AgI>AgCl>Ag2S
 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
下列关于海水的知识不正确的是( )
A.海水资源的利用包括海水水资源利用和化学资源利用
B.海水既苦又涩,不能直接利用
C.海水中某些金属元素总储量很大,但富集程度却很低
D.海水淡化应同化工生产结合,同能源技术结合
查看答案和解析>>
科目:高中化学 来源: 题型:
完成下面有关钠、镁、铝的计算及判断。
(1)取w g钠、镁、铝分别与足量盐酸反应,在相同条件下产生氢气的体积之比是________。
(2)取0.1 mol钠、镁、铝分别与足量盐酸反应,在相同条件下产生氢气的体积之比是________。
(3)若产生相同体积(同温同压)的氢气,所需钠、镁、铝三种金属的物质的量之比是________;质量之比是________。
(4)若将0.2 mol钠、镁、铝分别投入10 mL 1 mol·L-1盐酸中,在标准状况下产生氢气体积的大小顺序是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
用一定量的铁与足量的稀H2SO4及足量的CuO制成单质铜,有人设计以下两种方案:①Fe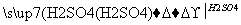 H2
H2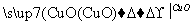 Cu ②CuO
Cu ②CuO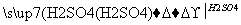 CuSO4
CuSO4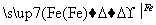 Cu
Cu
若按实验原则进行操作,则两者制得单质铜的量的比较中,正确的是 ( )
A.①多 B.②多
C.相等 D.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
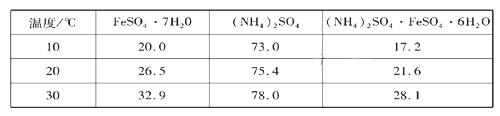
硫酸亚铁可与等物质的量的硫酸铵生成硫酸亚铁铵:(NH4)2SO4·FeSO4·6H2O,商品名称为莫尔盐,是一种复盐。一般亚铁盐在空气中易被氧气氧化,形成复盐后就比较稳定。与其他复盐一样,硫酸亚铁铵在水中的溶解度比组成它的每一种盐的溶解度都小,且几乎不溶于乙醇,利用这一性质可以制取硫酸亚铁铵晶体。三种盐的溶解度(单位为g/l00gH2O)见下表:
实验用品: Fe屑(含少量碳)、3mol/LH2SO4、( NH4)2SO4、蒸馏水、无水乙醇。
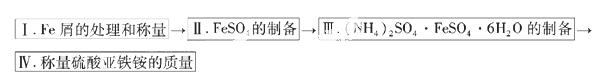
实验步骤流程图:
请完成以下实验记录:
(1)步骤I中用10% Na2CO3的热溶液处理铁屑的目的是 ,经处理后的干燥铁屑质量记为m1;
(2)将称量好的Fe屑放入锥形瓶中, 加入适量3mol/LH2SO4溶液,放在水浴中加热至气泡量产生较少时为止(有氢气生成,用明火加热注意安全)。趁热过滤,并用少量热水洗涤锥形瓶及滤纸,将滤液和洗涤液一起转移至蒸发皿中。将滤纸上的固体常温干燥后称重,记为m2;
加入适量3mol/LH2SO4溶液,放在水浴中加热至气泡量产生较少时为止(有氢气生成,用明火加热注意安全)。趁热过滤,并用少量热水洗涤锥形瓶及滤纸,将滤液和洗涤液一起转移至蒸发皿中。将滤纸上的固体常温干燥后称重,记为m2;
(3)称取一定质量的(NH4)2SO4,加入______ g(用含m1和m2的代数式表示,要求化简,下同。)水配制成室温下(20℃)的饱和溶液,并将其加入到上面实验的蒸发皿中,缓缓加热,浓缩至表面出现结晶薄膜为止。放置冷却,得到硫酸亚铁铵的晶体,过滤后用____________洗涤晶体。
(4)产品纯度的测定
先称取产品1.600g,加水溶解,配成100ml溶液,移取25.00mL待测溶液与锥形瓶中,再用硫酸酸化的0.0100mol/LKMnO4标准溶液进行滴定其中的Fe2+,达到滴定终点时消耗标准液的平均值为20.00mL,则样品中的(NH4)2SO4·FeSO4·6H2O的质量分数?(列式计算)
查看答案和解析>>
科目:高中化学 来源: 题型:
难溶电解质在水溶液中存在着电离平衡。在常温下,溶液里各离子浓度以它们化学计量数为方次的乘积是一个常数,叫溶度积常数(Ksp)。例如:Cu(OH)2(s)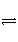
 Cu2+(aq)+2OH-,Ksp=[Cu2+]·[OH-]2=2×10-20 mol3·L-3。当溶液中各离子浓度方次的乘积大于溶度积时,则产生沉淀,反之固体溶解。
Cu2+(aq)+2OH-,Ksp=[Cu2+]·[OH-]2=2×10-20 mol3·L-3。当溶液中各离子浓度方次的乘积大于溶度积时,则产生沉淀,反之固体溶解。
(1)某CuSO4溶液里[Cu2+]=0.02 mol·L-1,如要生成Cu(OH)2沉淀,应调整溶液的pH,使之大于________。
(2)要使0.2 mol·L-1 CuSO4溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液里加入NaOH溶液,使溶液pH为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
原子序数依次增大的X、Y、Z、W四种短周期元素,X、W原子的最外层电子数与其电子层数相等,X、Z的最外层电子数之和与Y、W的最外层
电子数之和相等。甲的化学式为YX3,是一种刺激性气味的气体,乙是由X、Y、Z组成的盐。下列说法正
确的是 ( )
A.原子半径:W>Y>Z,简单离子半径: Y>Z>W
B.YX 3的空间构型是三角锥型,而Y2X4的空间构型类似于乙烯的空间构型
C.测得乙的水溶液呈酸性,则溶液中乙盐阳离子浓度大于酸根离子浓度
D. W的氯化物熔点低,易升华,但水溶液能导电,由此推断它属于弱电解质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com