
尿素[CO(NH2)2]是一种非常重要的高氮化肥,以天然气(含H2S)为原料 合成尿素的主要步骤如下图所示(图中某些转化步骤未列出)。

请回答下列问题:
(1)反应①的离子方程式是______________
(2)天然气脱硫后产生的Fe2S3和H2O与02反应的化学方程式是_______。
(3)反应②是放热反应,温度升高,该反应的平衡常数_______ (填 “增大”、“减小” 或“不变”)。H2NCOONH4 (氨基甲酸铵)是合成尿素的中间体,其中碳原子的杂化轨道类型是_______杂化。
(4)如果整个生产过程釆用绿色化学工艺,则生产 120t尿素理论上需要 CH4___m3 (标准状况)。
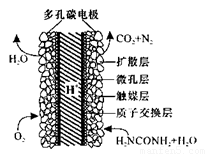
(5)化学家正在研究尿素动力燃料电池,尿液也能发电!用这种电池直接去除城市废水中的尿素,既能产生净化的水又能发电。尿素燃料电池结构如图所示,工作时负极的电极反应式为__________
(14分)
(1)CO32-+CO2+H2O=2HCO3-(2分)
(2)2Fe2S3+6H2O+3O2=4Fe(OH)3+6S(2分)
(3)减小(2分) sp2(2分) (4)4.48×104(3分)
(5)CO(NH2)2+H2O-6e-= N2↑+CO2↑+6H+(3分)
【解析】
试题分析:(1)反应①发生二氧化碳与碳酸钾溶液反应生成碳酸氢钾,其离子反应为CO32-+CO2+H2O═2HCO3-;(2)Fe2S3和H2O与02反应生成氢氧化铁和S,该反应为2Fe2S3+6H2O+3O2═4Fe(OH)3+6S;(3)反应②为合成氨的反应,放热反应,温度升高,平衡逆向移动,则平衡常数K减小;H2NCOONH4中的C原子上没有孤对电子,成键数为3,C原子采取sp2杂化;(4)由C原子守恒可知,CH4~CO2~CO(NH2)2,则生产120t尿素理论上需要CH4为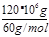 ×22.4L/mol×10-3m3=4.48×104m3;(5)尿素燃料电池中尿素再负极上失去电子生成氮气、二氧化碳,负极反应为CO(NH2)2+H2O-6e-═N2↑+CO2↑+6H+;
×22.4L/mol×10-3m3=4.48×104m3;(5)尿素燃料电池中尿素再负极上失去电子生成氮气、二氧化碳,负极反应为CO(NH2)2+H2O-6e-═N2↑+CO2↑+6H+;
考点:本题以尿素的合成为信息考查化学用语及化学平衡、电化学等知识,综合性较强,题目难度中等,第(5)问为学生解答的难点和易错点。


科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:
氨基磺酸(H2NSO3H)是一元固体强酸,溶于水和液氨,不溶于乙醇。在工业上用作酸性清洗剂、阻燃剂、磺化剂。用尿素[CO(NH2)2]和发烟硫酸(溶有SO3的硫酸)为原料合成氨基磺酸的路线如下:
(1)重结晶用10%~12%的硫酸作溶剂而不用水作溶剂的原因是______________
(2)“磺化”步骤中所发生的反应为:
①CO(NH2)2(s) + SO3(g) H2NCONHSO3H(s)△H<0
②H2NCONHSO3H + H2SO4 2H2NSO3H+ CO2↑
“磺化”过程应控制反应温度为75~80℃,若温度高于80℃,氨基磺酸的产率会降低,原因是_______________ 。
(3)测定产品中氨基磺酸纯度的方法如下:称取7.920g 产品配成l000mL待测液,量取25.00mL待测液于锥形瓶中,加入2mL 0.2mol·L-1稀盐酸,用淀粉碘化钾试剂作指示剂,逐滴加入0.08000mol·L-1NaNO2溶液,当溶液恰好变蓝时,消耗NaNO2溶液25.00mL,此时氨基磺酸恰好被完全氧化成N2,NaNO2的还原产物也为N2。试求产品中氨基磺酸的质量分数 。
(4)以酚酞为指示剂,用NaOH进行酸碱中和滴定也能测定产品中氨基磺酸的纯度,测定结果通常比NaNO2法偏高,原因是氨基磺酸中混有___________杂质。
查看答案和解析>>
科目:高中化学 来源:2012届福建省厦门六中高三12月月考化学试卷 题型:单选题
下列说法错误的是
| A.清晨茂密树林中缕缕阳光穿过枝叶铺洒在地面形成的美丽景色与胶体的性质有关 |
| B.元素周期律是元素原子核外电子排布随着元素核电荷数的递增发生周期性变化的必然结果 |
| C.尿素[CO(NH2)2]的合成突破了无机物和有机物的界限,人们用含碳无机物为原料合成了大量的有机物,创造了一个新的“自然界” |
| D.Na2CO3俗名小苏打,是焙制糕点所用发酵粉的主要成分之一 |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮专题冲刺第8讲 电化学基础练习卷(解析版) 题型:填空题
Ⅰ.(1)电镀时,镀件与电源的________极连接。
(2)化学镀的原理是利用化学反应生成金属单质沉淀在镀件表面形成镀层。若用铜盐进行化学镀铜,应选用________(填“氧化剂”或“还原剂”)与之反应。
Ⅱ.尿素[CO(NH2)2]是首个由无机物人工合成的有机物。人工肾脏可采用间接电化学方法除去代谢产物中的尿素,原理如图:
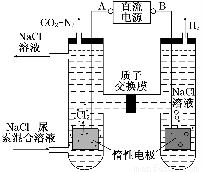
(1)电源的负极为________(填“A”或“B”)。
(2)阳极室中发生的反应依次为________、________。
(3)电解结束后,阴极室溶液的pH与电解前相比将________;若两极共收集到气体13.44 L(标准状况),则除去的尿素为________g(忽略气体的溶解)。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年浙江省杭州市高复高三上学期11月份月考化学试卷 题型:填空题
氨基磺酸(H2NSO3H)是一元固体强酸,溶于水和液氨,不溶于乙醇。在工业上用作酸性清洗剂、阻燃剂、磺化剂。用尿素[CO(NH2)2]和发烟硫酸(溶有SO3的硫酸)为原料合成氨基磺酸的路线如下:
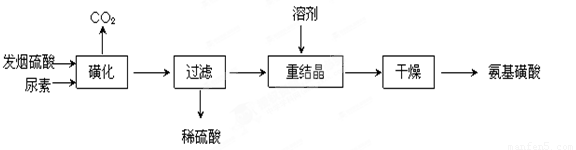
(1)重结晶用10%~12%的硫酸作溶剂而不用水作溶剂的原因是______________
(2)“磺化”步骤中所发生的反应为:
①CO(NH2)2(s) + SO3(g) 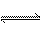 H2NCONHSO3H(s)
△H<0
H2NCONHSO3H(s)
△H<0
②H2NCONHSO3H + H2SO4  2H2NSO3H
+ CO2↑
2H2NSO3H
+ CO2↑
“磺化”过程应控制反应温度为75~80℃,若温度高于80℃,氨基磺酸的产率会降低,原因是_______________ 。
(3)测定产品中氨基磺酸纯度的方法如下:称取7.920g 产品配成l000mL待测液,量取25.00mL待测液于锥形瓶中,加入2mL 0.2mol·L-1稀盐酸,用淀粉碘化钾试剂作指示剂,逐滴加入0.08000mol·L-1NaNO2溶液,当溶液恰好变蓝时,消耗NaNO2溶液25.00mL,此时氨基磺酸恰好被完全氧化成N2,NaNO2的还原产物也为N2。试求产品中氨基磺酸的质量分数 。
(4)以酚酞为指示剂,用NaOH进行酸碱中和滴定也能测定产品中氨基磺酸的纯度,测定结果通常比NaNO2法偏高,原因是氨基磺酸中混有___________杂质。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com