
【题目】下列各反应中属于加成反应的是( )
A. H2+Cl2![]() 2HCl
2HCl
B. CH2===CH2+3O2![]() 2CO2+2H2O
2CO2+2H2O
C. CH2===CH2+H2O![]() CH3CH2OH
CH3CH2OH
D. CH3—CH3+2Cl2![]() CH2Cl—CH2Cl+2HCl
CH2Cl—CH2Cl+2HCl
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】超临界状态下的CO2流体溶解性与有机溶剂相似,可提取中药材的有效成分,工艺流程如下。

下列说法中错误的是( )
A.浸泡时加入乙醇有利于中草药有效成分的浸出
B.高温条件下更有利于超临界CO2流体萃取
C.升温、减压的目的是实现CO2与产品分离
D.超临界CO2流体萃取中药材具有无溶剂残留、绿色环保等优点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为672 mL的烧瓶中充满NO和NO2的混合气体,将其倒立在水槽里,去塞后再通入280 mL氧气,恰好完全反应,且液体充满烧瓶(气体体积都已折合为标准状况下的体积),下列有关叙述正确的是( )
A. 总反应为NO+NO2+O2+H2O===2HNO3
B. 总反应为4NO+8NO2+5O2+6H2O===12HNO3
C. 生成硝酸的物质的量浓度均为0.030 mol·L-1
D. 生成硝酸的物质的量浓度约为0.060 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钠常作漂白剂、杀菌剂、消毒剂。过氧化钠保存不当容易吸收空气中CO2而变质。
(1)某课外活动小组欲探究某过氧化钠样品是否已经变质,取少量样品,溶解,加入_______________溶液,充分振荡后有白色沉淀,证明Na2O2已经变质。
(2)该课外活动小组为了粗略测定过氧化钠的纯度,他们称取ag样品,并设计用如图装置 来测定过氧化钠的质量分数。

①A中发生反应离子方程式为___________________
②将仪器连接好以后,必须进行的第一步操作是__________
③写出装置C中发生的所有反应的化学方程式______________________________,_______________________________________________________
④D中NaOH溶液的作用__________________________
⑤读出量筒内水的体积后,折算成标准状况下氧气的体积为VmL,则样品中过氧化钠的质量分 数为__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】连二亚硫酸钠(Na2S2O4)俗称保险粉,易被氧气氧化。利用如图装置,在锥形瓶中加入HCOONa、NaOH、CH3OH和水形成的混合液,通入SO2时发生反应生成保险粉和一种常见气体,下列说法错误的是
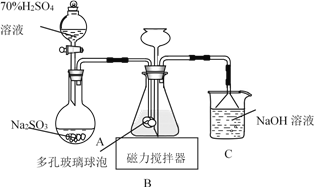
A. 制备保险粉的离子方程式为HCOO-+OH-+2SO2===S2O42-+CO2↑+H2O
B. NaOH溶液的主要作用是吸收逸出的CO2
C. 多孔玻璃球泡的作用是增大气体与溶液的接触面积,使SO2能被充分吸收
D. 为避免产生的Na2S2O4被O2氧化,使硫酸与亚硫酸钠先反应,产生的SO2排出装置中残留的O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)具有高效的消毒作用,为一种新型非氯高效消毒剂。已知:K2FeO4易溶于水、微溶于浓碱溶液,不溶于乙醇,在0~5 ℃的强碱性溶液中较稳定。实验室中常用KClO在强碱性介质中与Fe(NO3)3反应制备K2FeO4(夹持装置略去)。回答下列问题:
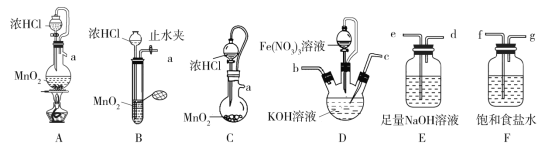
(1)盛放Fe(NO3)3溶液的仪器名称为______________________。
(2)氯气的发生装置可以选择图中的________(用图中大写字母表示);检查装置B气密性的操作为___________。
(3)选择上述装置,制备K2FeO4,按气流从左到右的方向,合理的连接顺序a→______(填仪器接口字母,仪器不可重复使用)。
(4)装置D中生成K2FeO4的离子方程式为__________;实验过程中若装置D的液面上方出现黄绿色气体后,再滴加Fe(NO3)3溶液会产生大量红褐色沉淀,用必要的文字和离子方程式分析原因:_______________
(5)制备的高铁酸钾粗产品中含有KNO3、KCl、Fe(OH)3等杂质,请将以下提纯步骤补充完整,(实验药品:高铁酸钾粗产品、蒸馏水、乙醇、饱和NaOH溶液、饱和KOH溶液、冷的稀KOH溶液、冰水)。
①取一定量的高铁酸钾粗产品,溶于_____________;
②过滤,将滤液置于冰水浴中,向滤液中加入饱和KOH溶液;
③搅拌、静置、过滤,用____________洗涤2~3次,在真空干燥箱中干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“太阳水”电池装置如图所示,该电池由三个电极组成,其中a为TiO2电极,b为Pt电极,c为WO3电极,电解质溶液为pH=3的Li2SO4-H2SO4溶液。锂离子交换膜将电池分为A、B两个区,A区与大 气相通,B区为封闭体系并有N2保护。下列关于该电池的说法错误的是( )
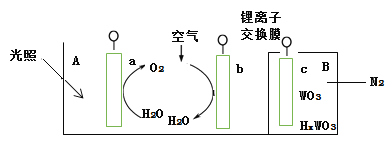
A.若用导线连接a、c,则a为负极,该电极附近pH减小
B.若用导线连接a、c,则c电极的电极反应式为HxWO3 - xe- =WO3 + xH+
C.若用导线先连接a、c,再连接b、c,可实现太阳能向电能转化
D.若用导线连接b、c, b电极的电极反应式为O2+4H++4e-=2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积不变的密闭容器中存在如下反应:2A(g)+B(g)![]() 3C(g);ΔH<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是
3C(g);ΔH<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是
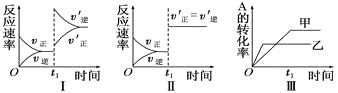
A. 图Ⅰ表示的是t1时刻增大反应物的浓度对反应速率的影响
B. 图Ⅱ表示的一定是t1时刻加入催化剂后对反应速率的影响
C. 图Ⅲ表示的是温度对化学平衡的影响,且乙的温度较高
D. 图Ⅲ表示的是不同催化剂对平衡的影响,且甲的催化效率比乙高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸锂广泛应用于陶瓷和医药等领域,在水中的溶解度比较小。以锂辉石(主要成分为Li2O,含有少量SiO2、Al2O3、Fe2O3)为原料制备Li2CO3的流程如图:
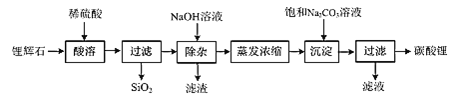
⑴写出“酸溶”时Li2O发生反应的离子方程式:______。
⑵“除杂”时所用NaOH溶液不能过量,原因是______。
⑶“除杂”时检验铁元素已完全除去的方法是______。
⑷写出“沉淀”时反应的化学方程式:______。
⑸检验最终所得碳酸锂样品中是否含有Na2CO3的方法是:______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com