
 用二氧化氯(ClO2)、铁酸钠(Na2FeO4摩尔质量为166g/mol)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术.ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+.
用二氧化氯(ClO2)、铁酸钠(Na2FeO4摩尔质量为166g/mol)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术.ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+.分析 (1)依据取1molClO2、Cl2、Na2FeO4,分别计算在氧化还原反应中元素化合价变化数目判断解答;
(2)Na2FeO4把H2O氧化为O2,氧气杀菌消毒,它本身被还原为Fe3+.Fe3+水解产生Fe(OH)3胶体吸附水中的悬浮物质.从而净化了水,据此写出反应的离子方程式;
(3)①甲醇与氯气在水溶液中发生氧化还原反应生成氯化氢和二氧化碳;
②由①中的两个反应方程式可以看出若转移相同的电子,Cl-的消耗与产生量相等,结合催化剂的概念解答;
③将第一步与第二步的方程式叠加可得总方程式:6ClO3-+CH3OH+6H+=CO2↑+6ClO2↑+5H2O.将副反应ClO3-+Cl-+H+-Cl2↑+H2O配平可得:ClO3-+5Cl-+6H+=3Cl2↑+3H2O若测得反应后的混合气体中Cl2的体积分数为3/73,假设气体的总物质的量为73mol,则Cl2为3mol;CO2和ClO2总物质的量为70mol.产生3mol的Cl2消耗NaClO3的物质的量1mol;根据方程式6ClO3-+CH3OH+6H+=CO2↑+6ClO2↑+5H2O可知产生CO2和ClO2总物质的量为70mol消耗CH3OH的物质的量为10mol;消耗 NaClO3的物质的量为60mol,据此计算解答;
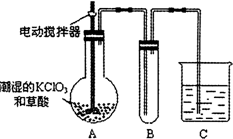
(4)①依据ClO2的沸点低,容易挥发的性质解答;
②C为尾气吸收装置,由于ClO2能与碱发生反应,所以通常用NaOH溶液来吸收,二者反应生成NaClO2、NaClO3、H2O.
解答 解:(1)ClO2、Na2FeO4、Cl2三种消毒杀菌剂的消毒效率分别是ClO2:67.5g÷5mol=13.5g/mol; Na2FeO4:166g÷3mol=55.33g/mol;Cl2:71g/2mol=35.5g/mol.所以三种消毒杀菌剂的消毒效率由大到小的顺序是ClO2>Cl2>Na2FeO4;
故答案为:ClO2>Cl2>Na2FeO4;
(2)根据题意可得Na2FeO4把H2O氧化为O2,氧气杀菌消毒,它本身被还原为Fe3+.Fe3+水解产生Fe(OH)3胶体吸附水中的悬浮物质.从而净化了水.该反应的离子方程式为:4FeO42-+10 H2O=4Fe(OH)3+8OH-+3O2↑;
故答案为:4FeO42-+10 H2O=4Fe(OH)3+8OH-+3O2↑;
(3)①甲醇与氯气在水溶液中发生氧化还原反应生成氯化氢和二氧化碳,所以第二步反应的离子方程式为:CH3OH+3Cl2+H2O=6Cl-+CO2+6H+;
故答案为:CH3OH+3Cl2+H2O=6Cl-+CO2+6H+;
②由①中的两个反应方程式可以看出若转移相同的电子,Cl-的消耗与产生量相等.之所以在工业生产时要在反应物中加少量Cl-,是因为Cl-起作催化剂作用;
故答案为:催化剂;
③将第一步与第二步的方程式叠加可得总方程式:6ClO3-+CH3OH+6H+=CO2↑+6ClO2↑+5H2O.将副反应ClO3-+Cl-+H+-Cl2↑+H2O配平可得:ClO3-+5Cl-+6H+=3Cl2↑+3H2O若测得反应后的混合气体中Cl2的体积分数为3/73,假设气体的总物质的量为73mol,则Cl2为3mol;CO2和ClO2总物质的量为70mol.产生3mol的Cl2消耗NaClO3的物质的量1mol;根据方程式6ClO3-+CH3OH+6H+=CO2↑+6ClO2↑+5H2O可知产生CO2和ClO2总物质的量为70mol消耗CH3OH的物质的量为10mol;消耗 NaClO3的物质的量为60mol.所以共消耗CH3OH的物质的量为10mol;消耗 NaClO3的物质的量为60mol+3mol=61mol.因此起始投料时CH3OH与NaClO3的物质的量之比为10:61=1:6.1;
故答案为:1:6.1;
(4)①因为ClO2的沸点低,容易挥发,所以B部分还应补充的装置是冷凝装置.可以用冰水进行降温;
故答案为:(冰水)冷凝;
②C为尾气吸收装置,由于ClO2能与碱发生反应,所以通常用NaOH溶液来吸收.反应的方程式为:2ClO2+2NaOH=NaClO2+NaClO3+H2O;
故答案为:2ClO2+2NaOH=NaClO2+NaClO3+H2O.
点评 本题考查饮用水的不同消毒剂的消毒效率的比较、ClO2的制法、性质及涉及的化学反应原理.主要包括氧化还原反应的化学方程式、离子方程式的配平、书写、实验装置的选择、应用和有关计算的知识,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱性溶液:Na+、Ca2+、SO42-、CO32- | |
| B. | 含有大量Fe3+的溶液:Na+、Mg2+、NO3-、SCN- | |
| C. | 氯水溶液:H+、Fe2+、SO42-、Cl- | |
| D. | 含有大量Al3+的溶液:Na+、NH4+、SO42-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
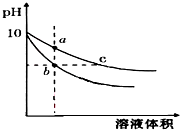 常温下,相同pH的氢氧化钠和醋酸钠溶液加水稀释,平衡时pH 随溶液体积变化的曲线如图所示,则下列叙述不正确的是( )
常温下,相同pH的氢氧化钠和醋酸钠溶液加水稀释,平衡时pH 随溶液体积变化的曲线如图所示,则下列叙述不正确的是( )| A. | b、c两点溶液的导电能力不相同 | |
| B. | a、b、c三点溶液中水的电离程度a>c>b | |
| C. | 用相同浓度的盐酸分别与等体积的b、c处溶液反应,消耗盐酸体积Vb=Vc | |
| D. | c点溶液中C(H+)+C(CH3COOH)=C(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 煤的干馏是煤气化的重要方法,也是煤综合利用最“古老”的、最简单的方法.某实验小组根据教材习题设计了煤干馏实验,装置如图所示.实验时,取约2-3g的煤粒,在研体中研磨至粉末状态;用药匙将煤粉放入试管中,在具支试管中加入2mL水,按照如图所示安装好装置;点燃酒精灯,对试管预热后再集中受热,待具支试管中气泡产生的速度均匀后,在具支试管口收集气体,并用明火靠近具支试管口,可以观察到产生的气体能够燃烧.根据上述实验回答下列问题:
煤的干馏是煤气化的重要方法,也是煤综合利用最“古老”的、最简单的方法.某实验小组根据教材习题设计了煤干馏实验,装置如图所示.实验时,取约2-3g的煤粒,在研体中研磨至粉末状态;用药匙将煤粉放入试管中,在具支试管中加入2mL水,按照如图所示安装好装置;点燃酒精灯,对试管预热后再集中受热,待具支试管中气泡产生的速度均匀后,在具支试管口收集气体,并用明火靠近具支试管口,可以观察到产生的气体能够燃烧.根据上述实验回答下列问题: +HNO3$→_{△}^{浓硫酸}$
+HNO3$→_{△}^{浓硫酸}$ +H2O;
+H2O;
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
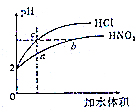 室温下,体积和pH都相同的盐酸和HNO2溶液加水稀释时的pH变化曲线如图所示,下列有关说法正确的是( )
室温下,体积和pH都相同的盐酸和HNO2溶液加水稀释时的pH变化曲线如图所示,下列有关说法正确的是( )| A. | 原HNO2溶液的浓度为0.01mol•L-1 | |
| B. | 溶液中水的电离程度:b>c | |
| C. | $\frac{c(N{{O}_{2}}^{-})}{c(HN{O}_{2})•c(O{H}^{-})}$比值:b>a | |
| D. | 等浓度的HNO2与NaOH溶液按体积比为2:1充分反应的混合液中,c(NO2-)+2c(OH-)=c(HNO2)+2c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
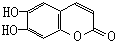 )具有抗癌作用.下列关于七叶树内酯的叙述中不正确的是( )
)具有抗癌作用.下列关于七叶树内酯的叙述中不正确的是( )| A. | 能被KMnO4酸性溶液氧化 | |
| B. | 既可以看成酚类化合物又可看成酯类化合物 | |
| C. | 能与银氨溶液发生银镜反应 | |
| D. | 1 mol该物质最多与3 mol Br2 发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (CH3CH2)2CHCH3的正确命名是2-乙基丁烷 | |
| B. | 有机物大多是分子晶体,则乙醇的沸点和它相对分子质量相近的烷烃相差不多 | |
| C. | 鉴别淀粉、蛋白质、葡萄糖水溶液,依次可分别使用的试剂且对应的现象,碘水、变蓝色;硫酸铜溶液,白色沉淀;新制Cu(OH)2,加热后有砖红色沉淀 | |
| D. | 验证某有机物属于烃,应完成的实验内容是测定该试样的质量及试样完全燃烧后生成CO2和H2O的质量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com