
【题目】已知某温度下AgCl(s)的溶度积常数Ksp=1×10-10。在该温度下,向50mL 0.018mol/L的AgNO3溶液中加入50mL 0.02mol/L的盐酸,生成沉淀(混合后溶液的体积变化忽略不计)。下列说法正确的是()
A.AgCl的溶解性为难溶,则该物质不溶于水
B.沉淀生成后,溶液中Ag+的浓度1×10-5mol/L
C.沉淀生成后,溶液中NO3-的浓度1.8×10-2mol/L
D.沉淀生成后,溶液的pH为2
【答案】D
【解析】
发生AgNO3+HCl=AgCl↓+HNO3,根据量判断出HCl过量,然后根据Ksp进行分析;
A.AgCl的溶解性为难溶,该物质在水中溶解性很小,绝对不溶于水的物质不存在,故A错误;
B.发生AgNO3+HCl=AgCl↓+HNO3,n(AgNO3)=50×10-3L×0.018mol·L-1,n(HCl)=50×10-3L×0.02mol·L-1,HCl过量,反应后溶液中c(Cl-)=![]() =0.001mol·L-1,Ksp=c(Ag+)×c(Cl-),代入数值,得出c(Ag+)=10-7mol·L-1,故B错误;
=0.001mol·L-1,Ksp=c(Ag+)×c(Cl-),代入数值,得出c(Ag+)=10-7mol·L-1,故B错误;
C.根据AgNO3+HCl=AgCl↓+HNO3,NO3-物质的量不变,因此反应后溶液中c(NO3-)=![]() =0.009mol·L-1,故C错误;
=0.009mol·L-1,故C错误;
D.反应后c(H+)=![]() =0.01mol·L-1,即pH=2,故D正确;
=0.01mol·L-1,即pH=2,故D正确;
答案:D。


 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案科目:高中化学 来源: 题型:
【题目】在一定温度下,改变反应物中n(SO2)对反应2SO2(g)+O2(g)2SO3(g) △H<0的影响如图所示,下列说法正确的是
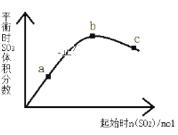
A.a、b、c三点中,平衡时的速率大小关系:v(b)>v(c)>v(a)
B.a、b、c三点中,a点时SO2的转化率最高
C.上述图象可以得出SO2的含量越高得到的混合气体中SO3的体积分数越高
D.a、b、c三点的平衡常数Kb>Kc>Ka
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列有机物中,经催化加氢后不能生成2﹣甲基戊烷的是
A.CH2=C(CH3)CH2CH2CH3B.CH2=CHCH(CH3)CH2CH3
C.CH3C(CH3)=CHCH2CH3D.CH3CH=CHCH(CH3)CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是
A.碳酸钠的水解反应CO32-+H2O=HCO3-+OH -
B.碳酸氢钙与过量的NaOH溶液反应Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32-
C.苯酚钠溶液与二氧化碳反应C6H5O-+CO2+H2O=C6H5OH+CO32-
D.稀硝酸与过量的铁屑反应3Fe+8H++2NO3-=3Fe3++2NO↑+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组以Mg(NO3)2为研究对象,拟通过实验初步探究硝酸盐热分解的规律.
(提出猜想)小组提出如下4种猜想:
甲:Mg(NO3)2、NO2、O2 乙:MgO、NO2、O2
丙:Mg3N2、O2 丁:MgO、NO2、N2
(1)查阅资料得知,NO2可被NaOH溶液吸收,反应的化学方程式为:____________.
(2)实验前,小组成员经讨论认定猜想丁不成立,理由是____________.
(实验操作)
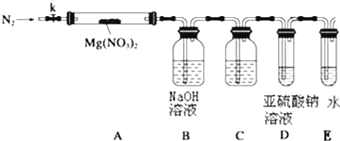
(3)设计如图装置,用氮气排尽装置中空气,其目的是___________;加热Mg(NO3)2固体,AB装置实验现象是:____________,说明有Mg(NO3)2固体分解了,有NO2生成.
(4)有同学提出可用亚硫酸钠溶液检验是否有氧气产生,但通入之前,还需在BD装置间增加滴有酚酞的氢氧化钠溶液,其作用是:____________
(5)小组讨论后认为即便通过C后有氧气,仅仅用亚硫酸钠溶液仍然难以检验,因为:____________,改进的措施是可在亚硫酸钠溶液中加入____________.
(6)上述系列改进后,如果分解产物中有O2存在,排除装置与操作的原因,未检测到的原因是____________.(用化学方程式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B代表不同的物质,都是H、N、O、Na中的任意三种元素组成的强电解质, A的水溶液呈碱性,B的水溶液呈酸性,请找出A、B可能的两种组合。要求:相同浓度时,A1溶液中水的电离程度小于A2溶液中水的电离程度;相同浓度时,B1溶液中水的电离程度小于B2溶液中水的电离程度。(说明:NH4NO2不稳定,不考虑),请填写下列空白:
(1)写出化学式:A1___________、A2__________、B1___________、B2___________。
(2)已知,Ka(HNO2)=4.60×10-4,则0.01molL-1 HNO2和0.01molL-1 A2等体积混合组成溶液中离子浓度由大到小的顺序为_______________。
(3)B1溶液中水的电离程度小于B2溶液中水的电离程度,原因是_________________。
(4)常温下,若B1、B2两种溶液的pH=5,则两溶液中由水电离出的氢离子的物质
的量浓度之比为________。
(5)常温下,0.01molL-1的HCOONa溶液的pH=10,则HCOOH的电离平衡常数Ka=_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)100°C时,KW=1.0×10-12,在该温度下,测得0.1mol/L Na2A溶液pH=6。
①H2A在水溶液中的电离方程式为_____;
②体积相等pH=1的盐酸与H2A溶液分别与足量的Zn反应,H2A溶液产生的H2_____(填“多”、“少”或“一样多”)。
(2)将0.4mol/L HA溶液与0.2mol/L NaOH溶液等体积混合,测得混合溶液中c(Na+)>c(A-):
①混合溶液中c(A)_____c(HA)(填“>”、“<”或“=”,下同);
②混合溶液中c(HA)+c(A)_____0.2mol/L。
(3)已知在常温下测得浓度均为0.1mol/L的下列5种溶液的pH,如表所示:
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
①少量二氧化碳通入NaClO溶液中的离子方程式_____;
②浓度均为0.01mol/L的下列4种物质的溶液分别加水稀释100倍,pH变化最小的是_____(填编号);
a.CH3COOH b.HCN c.HClO d.H2CO3
③常温下浓度相同的醋酸和醋酸钠混合液pH=6,则c(CH3COO-)-c(CH3COOH)=_____mol/L(填准确数值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备溴乙烷(C2H5Br)的装置和步骤如下:(已知溴乙烷的沸点38.4℃)①检查装置的气密性,向装置图所示的∪形管和大烧杯中加入冰水;②在圆底烧瓶中加入10mL95%乙醇、28mL78%浓硫酸,然后加入研细的13g溴化钠和几粒碎瓷片;③小心加热,使其充分反应.回答下列问题:

(1)该实验制取溴乙烷的化学方程式为:__.
(2)反应时若温度过高,可看到有红棕色气体产生,该气体分子式为__,同时生成的无色气体分子式为__.
(3)为了更好的控制反应温度,除用图示的小火加热,更好的加热方式是__.
(4)U型管内可观察到的现象是__.
(5)反应结束后,∪形管中粗制的C2H5Br呈棕黄色.为了除去粗产品中的杂质,可选择下列试剂中的__(填序号).
(a)NaOH溶液 (b)H2O (c)Na2SO3溶液 (d)CCl4
所需的主要玻璃仪器是__(填仪器名称).要进一步制得纯净的C2H5Br,可用水洗,然后加入无水CaCl2,再进行__(填操作名称).
(6)下列几项实验步骤,可用于检验溴乙烷中溴元素,其正确的操作顺序是:取少量溴乙烷,然后__(填代号).
①加热;②加入AgNO3溶液;③加入稀HNO3酸化;④加入NaOH溶液;⑤冷却.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.将0. 5mol N2和1.5molH2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为N2(g)+3 H2(g) ![]() 2 NH3(g) ΔH=-38.6kJmol-1
2 NH3(g) ΔH=-38.6kJmol-1
B.C(石墨)=C(金刚石)ΔH=+1.9kJmol-1,说明金刚石比石墨稳定
C.甲烷的燃烧热△H=-890. 3 kJmol-1,甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890. 3 kJmol-1
D.已知H+(aq)+OH-(aq)=H2O(l)△H=-57.4 kJmol-1,20g氢氧化钠固体溶于稀盐酸中恰好完全反应时放出的热量大于28.7kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com