
| A. | 每生成1mol Fe3O4转移4mol电子 | |
| B. | 该反应中Fe2+和S2O32-都是还原剂 | |
| C. | 3mol Fe2+被氧化时有1molO2被还原 | |
| D. | 反应方程式中化学计量数x=4 |
分析 根据氢原子守恒,水的化学计量数为2,则OH-的化学计量数为4,则方程式为3Fe2++2S2O32-+O2+4OH-=Fe3O4+S4O62-+2H2O,Fe元素的化合价升高,S元素的化合价升高,只有氧气中O元素的化合价降低,化合物中铁元素、硫元素用平均化合价,铁元素的化合价变化:+2→+$\frac{8}{3}$;硫元素的化合价变化为:+2→+$\frac{5}{2}$;氧元素的化合价变化:0→-2,所以氧化剂是O2还原剂是Fe2+、S2O32-,以此来解答.
解答 解:根据氢原子守恒,水的化学计量数为2,则OH-的化学计量数为4,则方程式为3Fe2++2S2O32-+O2+4OH-=Fe3O4+S4O62-+2H2O,化合物中铁元素、硫元素用平均化合价,铁元素的化合价变化:+2→+$\frac{8}{3}$;硫元素的化合价变化为:+2→+$\frac{5}{2}$;氧元素的化合价变化:0→-2,所以氧化剂是O2还原剂是Fe2+、S2O32-,
A、每生成1mol Fe3O4,由电子守恒及O元素的化合价变化可知,转移4mol电子,故A正确;
B、还原剂是Fe2+、S2O32-,故B正确;
C、方程式为3Fe2++2S2O32-+O2+4OH-=Fe3O4+S4O62-+2H2O,反应生成Fe3O4,可知2molFe2+被氧化,有1molO2被还原,故C错误;
D、根据氢原子守恒,水的化学计量数为2,则OH-的化学计量数为4,即x=4,故D正确;
故选C.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及转移电子的考查,注意从化合价角度分析,题目难度中等.


 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源: 题型:解答题
| 容器 | 甲 | 乙 | 丙 | |
| 反应物投入量 | 1molN2、3molH2 | 2molNH3 | 4molNH3 | |
| 平衡时数据 | 反应能量变化的绝对值(kJ) | Q1 | Q2 | Q3 |
| 反应物转化率 | a1 | a2 | a3 | |
| 体系压强(Pa) | p1 | P2 | P3 | |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体中含有的碳碳双键数为NA | |
| B. | 混合气体中含有的碳原子数为2NA | |
| C. | 当混合气体完全燃烧时,消耗O2的分子数为3NA | |
| D. | 当混合气体完全燃烧时,转移的电子数为12NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
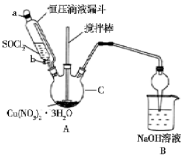 硝酸铜是一种重要的化工原料,实验室以含铁的铜屑为原料制备硝酸铜的过程如下,请按要求回答问题
硝酸铜是一种重要的化工原料,实验室以含铁的铜屑为原料制备硝酸铜的过程如下,请按要求回答问题| 开始沉淀的pH | 完全沉淀的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Cu2+ | 4.7 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有0.1mol•L-1Fe3+的溶液中:K+、Mg2+、I-、NO3- | |
| B. | 使酚酞试液变红的溶液:Na+、Cl-、SO42-、CO32- | |
| C. | 含有0.1mol•L-1Ca2+的溶液中:Na+、K+、CO32-、Cl- | |
| D. | 碳酸氢钠溶液:K+、SO42-、Cl-、H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素 | 相关信息 |
| X | X的最高价氧化物对应的水化物化学式为H2XO3 |
| Y | Y是地壳中含量最高的元素 |
| Z | Z元素的原子最外层有3个电子 |
| W | W的一种核素的质量数为28,中子数为14 |
| A. | W原子半径大于Z | |
| B. | 氢元素可以与X、Y分别形成的二元化合物分子间容易形成氢键 | |
| C. | 向Z单质与盐酸反应后的无色溶液中滴加NaOH溶液直至过量无现象 | |
| D. | W的单质与氢氟酸反应生成两种无色气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeO、ClO2、SO2都属于氧化物 | |
| B. | 液氯、铁单质、液态氯化氢都属于电解质 | |
| C. | 能发生丁达尔效应的分散系有NaCl溶液、水、蛋白质溶液等 | |
| D. | 除去氢氧化铁胶体中的Na+和Cl-可用过滤的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ②③④ | C. | ②④⑤⑥ | D. | 全部 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com