
����Ŀ��A��B��C��D��E Ϊ����������Ԫ�أ���ԭ��������������B��C��D��E λ��ͬһ���ڣ� A �ļ���̬�⻯����������������1 mol B �������������ᷴӦ���������ڱ�״���µ����Ϊ33.6 L��D ԭ������������������������֮��Ϊ 3��8��C ��ԭ���������� A ��������
(1)A��B �����Ӱ뾶�ɴ�С��˳��Ϊ______________ (�����ӷ���) ��
(2)C ��Ԫ�����ڱ��е�λ����_______________ ��
(3)A �ļ���̬�⻯��Ӵ��� E �ļ���̬�⻯��ʱ�ɹ۲쵽��������_____________��
(4) D �� E ���γ�ԭ�Ӹ�����Ϊ 1��2 �Ļ���������ʽΪ________��
(5)C��D��E �����̬�⻯���ȶ����ɸߵ��͵�˳����___________ (�û�ѧʽ���� )��
(6)B �� D �γɵĻ�������ˮѸ��ˮ�⣬д���÷�Ӧ�Ļ�ѧ����ʽ_______________________��
(7)�� E ������ NaOH ��Һ��Ӧ���� NaE��NaEO �� NaEO3���� 30mL 2mol/LNaOH ��_____mol E ����ǡ����ȫ��Ӧ(���� E ������ˮ�ķ�Ӧ�������ˮ�ⷴӦ)��
���𰸡�r(N3)��r(Al3+) �� N3��Al3+ �������� �ڢ�A �� �������� ![]() HCl��H2S��SiH4 Al2S3��6H2O =2Al(OH)3����3H2S�� 0.03
HCl��H2S��SiH4 Al2S3��6H2O =2Al(OH)3����3H2S�� 0.03
��������
A��B��C��D��EΪ�����ڵ�����Ԫ�أ���ԭ��������������B��C��D��Eλ��ͬһ���ڣ�A �ļ���̬�⻯������������������AΪNԪ�أ�1 mol B �������������ᷴӦ���������ڱ�״���µ����Ϊ 33.6 L����BΪAlԪ�أ�D ԭ������������������������֮��Ϊ 3��8����Dλ�ڵ������ڣ���DΪSԪ�أ�C ��ԭ��������A����������CΪSiԪ�أ�EԪ��Ϊ����������Ԫ����ԭ����������D����EΪClԪ�أ�
�������Ϸ�����֪��A��B��C��D��E�ֱ�ΪN��Al��Si��S��Cl��
��1��AΪNԪ����BΪAlԪ�أ���������Ų���ͬ���˵����Խ��뾶ԽС�������Ӱ뾶N3��Al3+��
��ˣ�������ȷ��Ϊ��N3��Al3+��
��2��CΪSiԪ���� ��Ԫ�����ڱ��е�λ���ǵ������� �ڢ�A �塣
��ˣ�������ȷ��Ϊ���������� �ڢ�A �壻
��3��A ���⻯���ǰ�����E���⻯����HCl��������ӽ��а������ɣ���ɷ�Ϊ�Ȼ�粒�����
��ˣ�������ȷ��Ϊ���������̣�
��4��D��SԪ�ء�E��ClԪ�أ�D��E���γ�ԭ�Ӹ�����Ϊ1��2�Ļ�����ΪSCl2��ÿ��Clԭ�Ӻ�Sԭ���γ�һ�Թ��õ��Ӷԣ������ʽΪ![]() ��
��
��ˣ�������ȷ��Ϊ��![]() ��
��
(5) CΪSiԪ�ء�DΪSԪ�ء�EΪClԪ�أ��ǽ�����Cl��S��Si�������⻯����ȶ���HCl��H2S��SiH4��
��ˣ�������ȷ��Ϊ��HCl��H2S��SiH4��
(6) BΪAlԪ�ء�DΪSԪ�أ�B��D�γɵĻ�����ΪΪAl2S3����ˮѸ��ˮ�⣬��Ӧ�Ļ�ѧ����ʽΪAl2S3��6H2O =2Al(OH)3����3H2S����
��ˣ�������ȷ��Ϊ��Al2S3��6H2O =2Al(OH)3����3H2S����
(7)EΪClԪ������Cl2�� NaOH ��Һ��Ӧ���� NaCl��NaClO �� NaClO3������ԭ���غ�
n(Cl2)=![]() n(Cl)=
n(Cl)=![]() n(Na)=
n(Na)=![]() n(NaOH)=0.030L�� 2mol/L��
n(NaOH)=0.030L�� 2mol/L��![]() =0.03mol��
=0.03mol��
��ˣ�������ȷ��Ϊ��0.03��


 ͨ��ѧ��Ĭд����ϵ�д�
ͨ��ѧ��Ĭд����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ȷ��ʾ���з�Ӧ�����ӷ���ʽ����
A��Cu�����Ȼ�����Һ��Cu��Fe3��=Cu2����Fe2��
B��Na2CO3��Һ�м�����CO![]() ��2H��=CO2����H2O
��2H��=CO2����H2O
C��AlCl3��Һ�м������ϡ��ˮ��Al3����4NH3��H2O=AlO![]() ��4NH
��4NH![]() ��2H2O
��2H2O
D��Ba(OH)2��Һ��ϡ��� Ba2++2OH��+2H++SO42��=BaSO4��+2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±�Ϊԭ��������������Ķ�����Ԫ��A~F�ĵ�һ��������������ݣ����еĽ���Ԫ����
������I��ev�� | A | B | C | D | E | F |
I1 | 5.2 | 7.6 | 6.0 | 11.3 | 13.6 | 14.5 |
I2 | 49.3 | 15.0 | 18.8 | 24.4 | 35.1 | 29.6 |
I3 | 71.6 | 80.1 | 28.4 | 47.9 | 54.9 | 47.4 |
I4 | 98.9 | 109.2 | 112.0 | 64.5 | 77.4 | 77.5 |
I5 | 138.3 | 141.3 | 153.7 | 392.1 | 113.9 | 97.9 |
A.A B CB.B C DC.C D ED.D E F
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������NaHCO3���ʵ��й�������ȷ����(����)
A. ֻ����ǿ�ᷴӦ,������ǿ�Ӧ
B. ҽ���Ͽ���������θ�����
C. ���������ᷴӦʱ�ų���CO2�ȵ�������Na2CO3Ҫ��
D. ͬ�¶�ʱ,NaHCO3���ܽ��>Na2CO3���ܽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Ԫ��X��Y��Z��M��W��Ԫ�����ڱ��е����λ����ͼ,����Z�ĺ˵������Y ������.����˵����ȷ����
![]()
A. Mλ��Ԫ�����ڱ��е���������A��
B. ԭ�Ӱ뾶��Z>M>X
C. ��̬�⻯������ȶ��ԣ�Y>X>W
D. W�������������NaOH��Ӧ��Ҳ����HF��Ӧ����������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ̽����ʯ��ƷA����������Ԫ�أ�����ɺ����ʣ���Ʋ��������ʵ�飺

��֪��ҺD��ֻ��һ�ֽ��������ӣ������۳�ַ�Ӧ�������������14 g��
��ش�
(1)��ƷA�Ļ�ѧʽΪ________________��
(2)д������c����ˮ��Ӧ�����ӷ���ʽ___________________��
(3)д����ƷA�����ᷢ��������ԭ��Ӧ�Ļ�ѧ����ʽ____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й������ڱ���˵����ȷ���ǣ� ��
A.ͬһ����Ԫ��ԭ�ӵ�������������ͬ
B.ͬһ����Ԫ��ԭ�ӵĵ��Ӳ�����ͬ
C.�����ɼ�Ľ������ڵڢ�A��
D.����������8��Ԫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�ϳ��Ը�����(��Ҫ�ɷ�Ϊ�Ǹ�������FeCr2O4������Al2O3��SiO2������)Ϊ��Ҫԭ�������췯��(Na2Cr2O7)��ijʵ��С��ģ������������ͼ��ʾ��
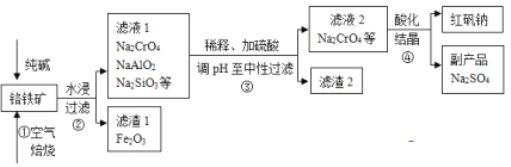
(1)������У�����ʱ���õ���������Ӧѡ��_________(������������������������ʯӢ����)��ѡ�øò��ʵ�ԭ����(��ϻ�ѧ����ʽ����)�� _____________________________________________��
(2)��ƽ���������Ҫ��Ӧ��
____FeCr2O4��___O2��___Na2CO3![]() ___Fe2O3��___Na2CrO4��___CO2 _____________
___Fe2O3��___Na2CrO4��___CO2 _____________
(3)�������У��ữʱ��CrO42�� (��ɫ)ת��ΪCr2O72��(��ɫ)��д��ƽ��ת�������ӷ���ʽ��____________________________________________________________���ú췯����Һ��������ʵ�飺
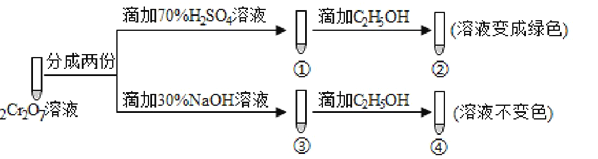
ʵ������У�������Һ��ɫ���������Һ��ƣ��ԱȢںܿ͢ɵó����ۣ�___________________��
(4)����������Ὣ��Һ��pH�������ԣ�������������Ҫ�ɷ���__________��____________��
(5)��ͼ��Na2Cr2O7��2H2O��Na2SO4���ܽ�����ߣ�������л�ù�̬����ƷNa2SO4��ʵ���������Ϊ____________��___________��

(6)ij�������õ�ⷨ����������ˮ�����������������������������ʢ�ź�����ˮ��ԭ��ʾ��ͼ���ϣ���������������ܽ⣬���ռ���H213.44L(��״����)ʱ�� ____________mol Cr2O72-����ԭ��һ��ʱ������Fe(OH)3��Cr(OH)3��������������Һ��c(Cr3+)=3.0��10��5mol��L��1����c(Fe3+)=_________��(��֪Ksp[Fe(OH)3]=4.0��10��38mol��L��1��Ksp[Cr(OH)3]=6.0��10��31mol��L��1)
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com