
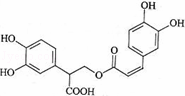
迷迭香酸是从蜂花属植物中提取得到的酸性物质,其结构如图.下列叙述正确的( )
|
| A. | 迷迭香酸分子中没有手性碳原子 |
|
| B. | 1mol迷迭香酸最多能和9mol氢气发生加成反应 |
|
| C. | 迷迭香酸可以发生水解反应、取代反应和酯化反应 |
|
| D. | 1mol迷迭香酸最多能和含5mol NaOH的水溶液完全反应 |
考点:
有机物的结构和性质.
专题:
有机物的化学性质及推断.
分析:
有机物中含有苯环和C=C,可与氢气发生加成反应,含有酚羟基、﹣COOH,二者都具有酸性,可与NaOH反应,含有﹣COO﹣,可发生水解,手性碳原子应连接4个不同的原子或原子团.
解答:
解:A.分子中连接﹣COOH的C原子为手性碳原子,故A错误;
B.分子中含有2个苯环、1个C=C,则1mol迷迭香酸最多能和7mol氢气发生加成反应,羧基中C=O不能发生加成反应,故B错误;
C.含有酯基,可发生水解反应,含有﹣OH、﹣COOH,可发生取代、酯化反应,故C正确;
D.分子中含有4个酚羟基、1个羧基和1个酯基,都能与NaOH反应,则1mol迷迭香酸最多能和含6molNaOH的水溶液完全反应,故D错误.
故选C.
点评:
本题考查有机物的结构和性质,注意把握有机物官能团的性质,为解答该题的关键,易错点为B,注意羧基中C=O不能发生加成反应,把握手性碳原子的判断.


 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案科目:高中化学 来源: 题型:
已知和碳元素同主族的X元素位于元素周期表中的第一个长周期,短周期元素Y原子的最外层电子数比内层电子总数少3,它们形成化合物的分子式是XY4。试回答:
(1)X元素的原子基态时电子排布式为: ____________________________,
Y元素原子最外层电子的电子排布图为:____________________________。
(2)若X、Y两元素电负性分别为2.1和2.85,试判断XY4中X与Y之间
的化学键为 (填“共价键”或“离子键”)。
(3)该化合物的空间结构为 ,中心原子的杂化类型为 ,
分子为 (填“极性分子”或“非极性分子”)。
(4)该化合物在常温下为液体,该液体微粒间的作用力是 。
(5)该化合物的沸点与SiCl4比较: (填化学式)的高,原因是
_________________________________________________________________
________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列措施对增大反应速率明显有效的是()
A. Na与水反应时增大水的用量
B. Fe与稀硫酸反应制取氢气时,改用浓硫酸
C. 将锌与稀硫酸反应时,向溶液中加入少量CuSO4 晶体
D. 用碳还原Fe2O3冶炼铁时,增大碳的用量
查看答案和解析>>
科目:高中化学 来源: 题型:
用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加大的是( )
|
| A. | 加热 |
|
| B. | 不用稀硫酸,改用98%的浓硫酸 |
|
| C. | 滴加少量CuSO4溶液 |
|
| D. | 不用铁片,改用铁粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式中,属于水解反应的是( )
|
| A. | HCO3﹣+H2O⇌H3O++CO32﹣ | B. | HCO3﹣+H2O⇌H2CO3+OH﹣ |
|
| C. | CO2+H2O⇌HCO3﹣+H+ | D. | CH3COOH⇌CH3COO﹣+H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)下列实验操作或对实验事实的叙述中不正确的是 (填序号)
①乙醇中含有少量水可加入生石灰再蒸馏制得无水乙醇
②配制银氨溶液时,将硝酸银慢慢滴入稀氨水溶液中,产生沉淀后继续滴加到沉淀刚好溶解为止
③制乙烯时,温度计应插入反应混合液中并控制温度在170℃
④向苯酚溶液中加入少量的稀溴水有白色沉淀生成
⑤实验室制备乙酸乙酯时吸收液为氢氧化钠溶液
⑥检验C2H5Cl中氯元素时,将C2H5Cl与NaOH水溶液混合加热,然后加入AgNO3溶液,观察是否有白色沉淀生成.
(2)现有下列8种有机物:(填选项,否则不得分)
A.甲苯 B苯乙烯 C苯酚 D溴乙烷 E乙醇 F甲醛 G乙酸 H甲酸钠
①能与氢气发生加成反应的有 .
②能发生消去反应的有 .
③能与氢氧化钠溶液反应的有 .
④常温下能与溴水发生取代反应的有 .
⑤能与乙酸发生酯化反应的有 .
⑥能与FeCl3溶液反应,并使溶液呈紫色的有 .
⑦能发生银镜反应的有 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是()
A. 一定温度下,在固定体积的密闭容器中发生可逆反应A(s)+B(g)═C(g)+D(g),当混合气体的密度不再改变时,说明已达到化学平衡状态
B. 对于反应C(s)+CO2(g)═2CO(g)△H>0,改变某一条件,若化学平衡常数增大,则反应速率也一定增大
C. 常温下向0.1mol•L﹣1的NH3•H2O中加入氯化铵固体,则溶液中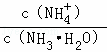 减小
减小
D. 常温下向Mg(OH)2悬浊液中加入MgCl2浓溶液后,溶液中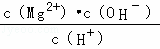 不变
不变
查看答案和解析>>
科目:高中化学 来源: 题型:
完成下列反应的离子方程式:
(1)Ba(OH)2溶液与(NH4)2SO4溶液混合:_______________________________。
(2)CuSO4溶液与Ba(OH)2溶液混合:_______________________________。
(3)NH4HCO3与过量NaOH溶液混合:_______________________________。
(4)Ba(OH)2与H2SO4两稀溶液混合:_______________________________。
(5)Fe2O3溶于HI溶液中:________________________________。
(6)FeBr2溶液中通入过量Cl2:_________________________________。
(7)FeO溶于稀HNO3中:_________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com