
【题目】某研究性学习小组选用以下装置进行实验设计和探究(图中a、b、c均为止水夹):
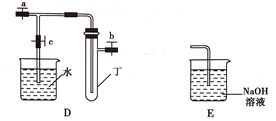
(1)在进行气体制备时,应先检验装置的气密性。将A装置中导管末端密封后,在分液漏斗甲内装一定量的蒸馏水,然后__________________________________________,则证明A装置的气密性良好。
(2)利用E装置能吸收的气体有__________________________________(任写两种即可)。
(3)用锌粒和稀硫酸制备H2时应选用装置________作为发生装置(填所选装置的字母序号),实验时先在稀硫酸中加入少量硫酸铜晶体可使反应速率加快,原因是___________________________。
(4)某同学将A、C、E装置连接后设计实验比较Cl-和S2-的还原性强弱。
①A中玻璃仪器乙的名称为______________________,A装置中发生反应的离子方程式为
_____________________________________________。
②C中说明Cl-和S2-的还原性强弱的实验现象是_______________________________________。
(5)另一同学将B、D、E装置连接后,在B装置中加入铜片和浓硝酸,制取NO2,然后进行NO2气体与水反应的实验,并观察相关现象:
①B装置中发生反应的离子方程式为________________________________________________。
②反应一段时间后D装置中的具支试管丁中收集满NO2气体,若进行NO2气体与水反应的实验,应____________________________________(填对a、b、c三个止水夹进行的操作),然后再适当加热丁。实验现象为____________________________________________________________。
【答案】 打开分液漏斗开关,水不能持续滴下或分液漏斗中液面长时间保持不变 CO2、H2S、Cl2、SO2等气体中任选两种 B Zn和置换出的铜与电解质溶液形成原电池 圆底烧瓶 MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O 产生淡黄色沉淀 Cu+4H++2NO=Cu2++2NO2↑+2H2O 关闭止水夹a、b,打开止水夹c 烧杯中的水进入具支试管中,具支试管中气体颜色变浅
Mn2++Cl2↑+2H2O 产生淡黄色沉淀 Cu+4H++2NO=Cu2++2NO2↑+2H2O 关闭止水夹a、b,打开止水夹c 烧杯中的水进入具支试管中,具支试管中气体颜色变浅
【解析】本题主要考查实验设计和探究。
(1)将A装置中导管末端密封后,在分液漏斗甲内装一定量的蒸馏水,然后打开分液漏斗开关,水不能持续滴下或分液漏斗中液面长时间保持不变,则证明A装置的气密性良好。
(2)利用E装置能吸收的气体有CO2、H2S、Cl2、SO2等酸性气体中任选两种。
(3)用锌粒和稀硫酸制备H2时,反应不需要加热,应选用装置B作为发生装置,实验时先在稀硫酸中加入少量硫酸铜晶体可使反应速率加快,原因是Zn和置换出的铜与电解质溶液形成原电池。
(4)①A中玻璃仪器乙的名称为圆底烧瓶,A装置中发生反应的离子方程式为MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O。
Mn2++Cl2↑+2H2O。
②C中说明Cl-和S2-的还原性强弱的实验现象是产生淡黄色沉淀。
(5)①B装置中发生反应的离子方程式为Cu+4H++2NO=Cu2++2NO2↑+2H2O。
②反应一段时间后D装置中的具支试管丁中收集满NO2气体,若进行NO2气体与水反应的实验,应关闭止水夹a、b,打开止水夹c,然后再适当加热丁。实验现象为烧杯中的水进入具支试管中,具支试管中气体颜色变浅。


 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:
【题目】浓度为0.50mol·L-1的某金属阳离子Mn+的溶液10.00mL,与0.40mol·L-1的NaOH溶液12.50mL完全反应,生成沉淀,则n等于
A.1B.2C.3D.4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在细胞内含量极少,但对维持生命活动必不可少的元素有( )
A.Fe Mn Zn Mg B.Zn Cu Mg Ca
C.Zn Cu B Mn D.Mg Mn Cu Mo
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用氯碱工业中的固体废物盐泥(主要成分为Mg(OH)2、CaCO3、BaSO4,除此之外还有NaCl、Al(OH)3、Fe(OH)3、Mn(OH)2等。)与废稀硫酸反应制备七水硫酸镁,产率高,既处理了三废,又有经济效益。其工艺流程如下:
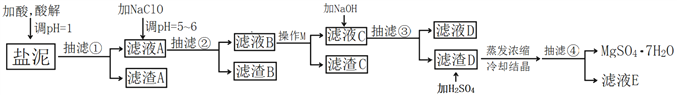
已知:
i)部分阳离子以氢氧化物形式完全沉淀时溶液的pH
沉淀物 | Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
pH值(完全沉淀) | 10.02 | 8.96 | 3.20 | 4.70 | 11.12 |
ii)两种盐的溶解度图(单位为g/100g水)

根据以上流程图并参考表格pH数据和溶解度图,请回答下列问题。
(1)酸解时,加入的酸为____________,在酸解过程中,想加快酸解速率,请提出两种可行的措施____________、____________。
(2)加入的NaClO可与Mn2+反应产生MnO2沉淀,该反应的离子方程式是____________。
(3)本工艺流程多次用到抽滤操作,其优点在于____________,四次抽滤时:抽滤①所得滤渣A的成分为____________、CaSO4;抽滤②所得滤渣B的成分为MnO2、____________、____________;抽滤③所得滤液C中主要杂质阳离子的检验方法是____________;抽滤④将产品抽干。
(4)依据溶解度曲线,操作M应采取的方法是适当浓缩,____________。
(5)每制备1吨MgSO4·7H2O,需要消耗盐泥2吨。若生产过程中的转化率为70%,则盐泥中镁(以氢氧化镁计)的质量分数约为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH3OH是一种无色有刺激性气味的液体,在生产生活中有重要用途,同时也是一种重要的化工原料.
(1)已知CH3OH(g)+ ![]() O2(g)
O2(g)![]() CO2(g)+2H2(g)能量变化如图,下列说法正确的是______
CO2(g)+2H2(g)能量变化如图,下列说法正确的是______
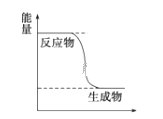
A.CH3OH转变成H2的过程是一个吸收能量的过程
B.H2的生成速率与CH3OH的消耗速率之比为1:2
C.化学变化不仅有新物质生成,同时也一定有能量变化
D.1molH-O键断裂的同时2molC=O键断裂,则反应达最大限度
(2)某温度下,将5molCH3OH和2molO2充入2L的密闭容器中,经过4min反应达到平衡,测得c(O2)=0.2mol·L-1,4min内平均反应速度v(H2)=__________ ,则CH3OH的转化率为______ 。
(3)甲醇燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、空气、KOH(电解质溶液)构成,则下列说法正确的是 ______
A.电池放电时通入空气的电极为负极
B.电池放电时负极的电极反应式为CH3OH-6e-=CO2↑+2H2O
C.电池放电时,电解质溶液的碱性逐渐减弱
D.电池放电时每消耗6.4gCH3OH转移1.2mol电子
(4)写出甲醇燃料电池在酸性条件下负极的反应式为 ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 ![]() (x)、
(x)、![]() (y)、
(y)、![]() (z) 互为同分异构体,下列说法正确的是
(z) 互为同分异构体,下列说法正确的是
A. z的二氯代物有4种
B. x 和y 的所有原子均可能处于同一平面
C. 1分子y与1分子Br2 的加成产物有3 种(不考虑立体异构)
D. x、y、z 均可使溴的四氯化碳溶液因发生加成反应而褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表所示的五种元素中,W、X、Y、Z为短周期元素,这四种元素的原子最外层电子数之和为22。下列说法正确的是

A. X、Y、Z三种元素最低价氢化物的沸点依次升高
B. 由X、Y和氢三种元素形成的化合物中只有共价键
C. T元素单质具有半导体的特性,T与Z元素可形成化合物TZ4
D. T的氢化物的沸点一定高于同主族元素形成的其他氢化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由海水制备无水氯化镁,主要有以下步骤:①在一定条件下脱水干燥;②加熟石灰;③加盐酸;④过滤;⑤浓缩结晶。其先后顺序正确的是( )
A.②④⑤③①B.③②④①⑤C.③④②⑤①D.②④③⑤①
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com