
| A. | 生成物能量一定低于反应物总能量 | |
| B. | 放热反应的△H>0,吸热反应的△H<0 | |
| C. | 应用盖斯定律,可计算某些难以直接测量的反应焓变 | |
| D. | 同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件的△H不同 |
分析 A.反应可能为吸热或放热反应;
B.放热反应的焓变为负;
C.难以直接测量的反应焓变,可间接计算得到;
D.焓变与反应条件无关.
解答 解:A.生成物能量可能低于(或高于)反应物总能量,故A错误;
B.放热反应的△H<0,吸热反应的△H>0,故B错误;
C.难以直接测量的反应焓变,可利用盖斯定律计算得到,故C正确;
D.焓变与反应条件无关,则H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件的△H相同,故D错误;
故选C.
点评 本题考查反应热与焓变,为高频考点,把握反应中能量变化、盖斯定律的应用、焓变与反应条件为解答的关键,侧重分析与应用能力的考查,注意选项D为易错点,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 单质硅可用于制造光纤和太阳能电池 | |
| B. | 火柴头的主要成分是氯酸钾和硫单质,分别属于电解质和非电解质 | |
| C. | 在常温下可用铝制容器贮藏运输浓硫酸 | |
| D. | BaSO4难溶于酸,所以可以用稀盐酸和Ba(NO3)2溶液检验SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | 芒硝 | NaNO3 |
| B | 熟石膏 | 2CaSO4•H2O |
| C | 明矾 | KAl(SO4)2 |
| D | 绿矾 | FeCl2•7H2O |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 冰融化为水的过程△H>0,△S<0 | |
| B. | 在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的方向 | |
| C. | 在常温下,放热反应一般能自发进行,吸热反应都不能自发进行 | |
| D. | NH4HCO3(s)?NH3(g)+H2O(g)+CO2(g)△H=+185.57kJ/mol,能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 对于反应:H2(g)+Cl2(g)=2HCl (g)△H=-a kJ/mol,表明破坏旧化学键吸收的能量比形成新化学键释放的能量多 | |
| B. | 2MnO(s)+O2(g)═2MnO2(s),该反应在低温下能自发进行,则其△H<0 | |
| C. | 用干燥的pH试纸测得某氯水的pH=3.1 | |
| D. | 航行在大海中的轮船水面上的部分比水面下的部分腐蚀得慢,因为水下易发生电化学腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 新制氯水中:c(H+)=c(HClO)+2c(ClO-)+c(OH-) | |
| B. | pH=8的NaClO2溶液中:c(Na+)>c(ClO2-)>c(OH-)>c(H+) | |
| C. | 0.1mol•L-1HCl溶液与0.2 mol•L-1 NH3•H2O溶液等体积混合pH>7:c(NH3•H2O)>c(Cl-)>c(NH4+)>c(OH-) | |
| D. | 0.1mol•L-1K2C2O4溶液与0.2 mol•L-1KHC2O4溶液等体积混合:4c(K+)=3[c(C2O42-)+c(HC2O4-)] |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
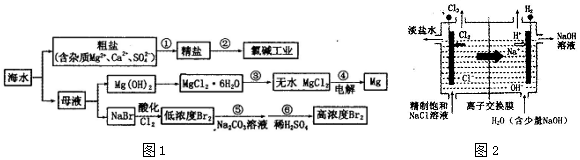
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{4c-b-2a}{2}$ kJ | B. | $\frac{4c+b-2a}{2}$ kJ | C. | (4c+b-2a) kJ | D. | (4c-b+2a) kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com