
 短周期主族元素W、X、Y、Z的原子序数依次增大,Y和Z位于同一主族.m、n、p均为由这些元素组成的二元化合物,甲、乙、丙为其中三种元素对应的单质,丙为黄色固体,易溶在XZ2中,p是一种二元弱酸.上述物质的转化关系如图所示(反应条件省略).下列说法正确的是( )
短周期主族元素W、X、Y、Z的原子序数依次增大,Y和Z位于同一主族.m、n、p均为由这些元素组成的二元化合物,甲、乙、丙为其中三种元素对应的单质,丙为黄色固体,易溶在XZ2中,p是一种二元弱酸.上述物质的转化关系如图所示(反应条件省略).下列说法正确的是( )| A. | 原子半径:W<X<Y | |
| B. | W与X组成的化合物中可能含有极性键和非极性键 | |
| C. | Y与Z组成的化合物一定有漂白性 | |
| D. | W与X、Y、Z组成的简单化合物的稳定性:X>Y>Z |
分析 丙为黄色固体,应为S,易溶在XZ2中,可知X为C元素,Z为S元素,Y和Z位于同一主族,则Y为O元素,p是一种二元弱酸,且和n反应生成S单质,则p为H2S,由此可知W为H元素,结合转化关系可知乙为S,甲为O2,丙为H2,n为SO2,以此解答该题.
解答 解:由以上分析可知W为H、X为C、Y为O、Z为S元素,甲为O2,乙为S,丙为H2,m为H2O,n为SO2,p为H2S,
A.同周期元素从左到右原子半径逐渐减小,则C>O,故A错误;
B.H和C可形成多种烃,分子含有C-C键、C-H键,含有非极性键和极性键,故B正确;
C.如为SO3,则不具有漂白性,故C错误;
D.非金属性O>S>C,则对应的氢化物的稳定性性O>S>C,故D错误.
故选B.
点评 本题考查无机物的推断,为高频考点,侧重分析与推断能力的考查,注意元素化合物知识的应用,丙为推断的突破口,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 若增大压强,则物质Y的转化率减小 | |
| B. | 将容器体积变为5 L,Z的平衡浓度变为原来的2倍 | |
| C. | Y浓度变化表示的反应速率为0.0005 mol/(L•s ) | |
| D. | 若升高温度,X的体积分数增大,则该反应的△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 能与乙醇发生酯化反应 | |
| B. | 能使酸性高锰酸钾溶液褪色 | |
| C. | 能与溴的四氯化碳溶液发生取代反应 | |
| D. | 1molM与足量Na完全反应能生成1molH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
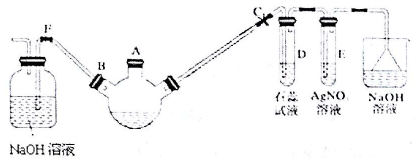
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯能使溴水褪色是因为苯与溴水发生了化学反应 | |
| B. | 欲从碘的苯溶液中分离出碘,通常采用萃取法 | |
| C. | 苯和不溶于水且密度比水大的四氯化碳都是无色液体,用试管和水就可以区别它们 | |
| D. | 因为苯通常是无色液体,所以在0℃的环境中可以直接将苯从试剂瓶倒人试管中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 预期的实验现象和结论 |
| 步骤:取一定量的固体产物于试管中,加入适量蒸馏水进行溶解,然后往试管中加入适量的 CuCl2溶液并过滤. | \ |
| 步骤2: 取1的滤液加入酚酞试液,若溶液变红, | 说明有NaOH |
| 步骤3: 取1的滤液加入BaCl2溶液,若产生白色沉淀, | 说明有Na2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 阳离子 | K+ Cu2+ Fe3+ Al3+ Fe2+ |
| 阴离子 | Cl- CO32- NO3- SO42- SiO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com