
I������ռ������Ҫ�Ļ���ԭ�ϡ�

��1��������ͼ��ʾװ�ÿɼ��֤��������̼���ռ���Һ�����˷�Ӧ����A��B���ӣ���ֹˮ�У�����ͷ�ι��е�Һ�強����ƿ����ʱ��ʵ��������___________________��
�������������䣬��A��C���ӣ��ɹ۲쵽��������__________________________��
��2����NaOH��Һ��ͨ��һ����CO2���ᾧ��õ���ɫ���壬�ð�ɫ�������ɿ�������
A��NaOH��Na2CO3��B����������������C������������������D����������������
��3�����ʵ��ȷ����2���а�ɫ�����д���A���е������ӣ�
ʵ����� | ʵ������ | ���� |
��ȡ������ɫ�������Թ��У�������ˮ�ܽ⣬�ټ�����BaCl2��Һ |
|
|
��
|
|
|
II����ѧ��ȤС���ijƷ�������е�Ħ�����ɷּ��京����������̽����
������ϣ�������Ħ������̼���������������ɣ������������ɷ���������ʱ�����������
������Ʒ��̼��ƵĶ����ⶨ��������ͼ��ʾװ��(ͼ�мг�������ȥ)����ʵ�飬��ַ�Ӧ
�ⶨC�����ɵ�BaCO3������������ȷ��̼��Ƶ�����������

����ʵ����̻ش��������⣺
��1��ʵ����������������ͨ������������ó��˿ɽ���B��C�еķ�Ӧ���⣬���У� ��
��2��C�з�Ӧ����BaCO3�����ӷ���ʽ�� ��
��3�����и����ʩ�У�������߲ⶨȷ�ȵ����� ��
A���ڼ�������֮ǰ��Ӧ�ž�װ���ڵ�CO2����
B���μ�����˹���
C����A��B֮������ʢ��Ũ�����ϴ��װ��
D����B��C֮������ʢ�б���̼��������Һ��ϴ��װ��
��4��ʵ����ȷ��ȡ8.00 g��Ʒ���ݣ��������βⶨ�����BaCO3ƽ������Ϊ3.94 g.����Ʒ��̼��Ƶ���������Ϊ________��
��5��������Ϊ���زⶨC�����ɵ�BaCO3������ֻҪ�ⶨװ��C������CO2ǰ��������һ������ȷ��̼��Ƶ�����������ʵ��֤�����˷����ⶨ�Ľ������ƫ�ߣ�ԭ���� _________________________________��
��6��װ����U�ι�D�еļ�ʯ�ҵ�������_____________________________��
I����1��ˮ�ص����ɹ��ƿ������ƿ ���ƿ�еij����ܿ������ݲ���
��2��Na2CO3 Na2CO3��NaHCO3 NaHCO3
��3��
ʵ����� | ʵ������ | ���� |
��1�� | ������ɫ���� | ��CO32�� |
��2�����ˣ�ȡ������Һ���Թ��У��μӷ�̪ | ��Һ��� | ��OH�� |
II����1�������ɵ�CO2ȫ������C�У�ʹ֮��ȫ��Ba(OH)2��Һ����
��2��Ba2++2OH-+CO2=BaCO3��+H2O ��3��C D ��4��25%
��5��B��ˮ�������Ȼ�������Ƚ���Cװ���� ��6����ֹ�����е�CO2����C
��������
���������I����1��CO2+2NaOH=Na2CO3+H2O���ڶ��߷�����Ӧ����Aװ�õ�����ѹǿ��С��Bװ���е�ˮ�ڴ���ѹ�������¾������ܽ���Aװ�á��������������䣬��A��C���ӣ��ɹ۲쵽�������ǹ��ƿ�еij����ܿ�ð���ݡ���2����NaOH��Һ��ͨ��һ����CO2�����ܷ����ķ�ӦΪ��2NaOH+CO2= Na2CO3+H2O��NaOH+CO2= NaHCO3�����Խᾧ��õ���ɫ���壬�ð�ɫ�������ɿ����ǣ�A��NaOH��Na2CO3��B��Na2CO3��C��Na2CO3��NaHCO3��D��NaHCO3����3����ȡ������ɫ�������Թ��У�������ˮ�ܽ⣬�ټ�����BaCl2��Һ��������ɫ����֤������CO32�����ӡ������ˣ�ȡ������Һ���Թ��У��μӷ�̪����Һ���֤������OH����
II����1��ʵ����������������ͨ������������ó��˿ɽ���B��C�еķ�Ӧ���⣬���������ɵ�CO2ȫ������C�У�ʹ֮��ȫ��Ba(OH)2��Һ���ա���2��C�з�Ӧ����BaCO3�����ӷ���ʽ��Ba2++2OH-+ CO2= BaCO3��+H2O����3��A���ڼ�������֮ǰ��Ӧ�ž�װ���ڵ�CO2������Լ��ٿ����еĶ�����̼�Բ���������Ӱ�죬��Сʵ�������ʵ���ȷ�ȡ�����B���μ�����˹�������Ƿ�Ӧ�����Ķ�����̼���屻����������Һ������գ���߷�Ӧ��ȷ�ȡ�����C����A��B֮������ʢ��Ũ�����ϴ��װ�ã�����ˮ�ֶԶ�����̼�����IJⶨ��Ȼ��Ӱ�졣��ȷ��D������B��C֮������ʢ�б���̼��������Һ��ϴ��װ�ã����ɷ�Ӧ��ӷ�������HCl���������䷴Ӧ����������̼���壬ʹ�ⶨ���ƫ����ȷ����ѡ��Ϊ��C D����4���ɷ���ʽCaCO3+2HCl=CaCl2+ CO2��+H2O; CO2+ Ba(OH)2= BaCO3��+H2O���ɵù�ϵʽCaCO3-- BaCO3����100g CaCO3��197g BaCO3.��BaCO3����Ϊ3.94 g�����Ժ��е�CaCO3������Ϊ2.0g. ��Ʒ��̼��Ƶ���������Ϊ(2.0g��8.0g)��100%=25%.��5��B��ˮ�������Ȼ�������Ƚ���Cװ����.��6��װ����U�ι�D�еļ�ʯ�ҵ���������ֹ�����е�CO2����C ,�Է�ֹӰ��ʵ��ⶨ�����ȷ�ԡ�
���㣺���������̼�Ļ�ѧ���ʼ���ʵ����������ʳɷֵIJⶨ�����ʵij�ȥ�������ܲ���ʵ�����ķ�����֪ʶ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2016�������ʡ��һ��ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
�������������������д���ֱ����1��100nm�����ӣ����ִ������ڣ� ��
A����Һ B������Һ C������Һ D������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016������ʡ�����и�һ�Ͻ�ѧ������⻯ѧ�Ծ��������棩 ���ͣ������
ȡ20 mL NaOH��Һƽ���ֳ����ݣ��ֱ����A��B��֧�Թ��С���A��B��ͨ�벻������CO2���ټ���������Һ����μ���0.1mol/L�����ᣬ��״���²�����CO2������������ӵ�������Һ���֮��Ĺ�ϵ���±���ʾ��
������������mL�� | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 |
A����CO2����� | 0 | 0 | 0 | 0 | 0 | 22.4 | 44.8 | 44.8 | 44.8 |
B����CO2����� | 0 | 0 | 22.4 | 44.8 | 67.2 | 89.6 | x | x | x |
��ش���������
��1������CO2��NaOH��Һ��Ӧ�����ӷ���ʽ ��
����CO2��NaOH��Һ��Ӧ�Ļ�ѧ����ʽ ��
��2���Թ�A��ͨ��CO2��������Һ������Ϊ ��
��3��ԭNaOH��Һ�����ʵ���Ũ��Ϊ mol/L��
��4���μ�70mL����ʱ��A��B����CO2�������Ϊ���ֵ����x= mL��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016������ʡ�����и�һ�Ͻ�ѧ������⻯ѧ�Ծ��������棩 ���ͣ�ѡ����
ij��Һ�к���Na+ ��CO32���� HCO3���� SO32���� Cl�����ڼ���Na2O2��Ũ�Ȳ������仯����
A��Na+ ��CO32�� B��Cl�� C��CO32����Cl�� D��HCO3����SO32��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016������ʡ�����и�һ�Ͻ�ѧ������⻯ѧ�Ծ��������棩 ���ͣ�ѡ����
��NA��ʾ�����ӵ�����������˵������������
A��0.1mol/Lϡ�����к�����������Ӹ���Ϊ0.1NA
B��32g O2��O3��������к���ԭ����Ϊ2NA
C��1molMg������N2��Ӧ����Mg3N2ʧȥ�ĵ�����Ϊ2NA
D��1mol H2��O2�Ļ�������ڱ�״���µ����ԼΪ22.4L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016������ʡ��һ��ѧ��12���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
��һ��������þ���������Ͷ��200 mLϡ�����У�����ȫ���ܽ����������Һ�м���NaOH��Һ�����ɳ��������ʵ���������NaOH��Һ����ı仯��ϵ��ͼ��ʾ��������˵������ȷ������ ��
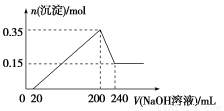
A��þ������������Ϊ9 g
B���Ͻ���ϡ���ᷴӦ���ɵ��������Ϊ10.08 L
C��ϡ��������ʵ���Ũ��Ϊ2.5 mol/L
D������������Һ�����ʵ���Ũ��Ϊ5 mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016������ʡ��һ��ѧ��12���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
�ס��ҡ��������ֱ�������������Һ���������Һ��̼������Һ��������Һ�е�һ�֣��ͱ����Է�Ӧ���Ͷ�Ҳ���Է�Ӧ��������˵����ȷ���ǣ� ��
A����һ������������ B����һ�����������Һ
C������������̼������Һ D����ֻ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016������ʡ�����и�һ��ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
���к�0��1 mol/L��SO32-��Һ30 mL,ǡ�ñ�2��10��3 mol XO4������ΪSO42-����Ԫ��X�ڻ�ԭ�����еĻ��ϼ���
A����4 �� B����3 �� C����2 �� D����1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�����ʡ��һ��ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
���з�Ӧ�϶�������������ԭ��Ӧ����
A�����Ϸ�Ӧ B���ֽⷴӦ C���û���Ӧ D�����ֽⷴӦ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com