
分析 由①CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H1=-49.1kJ•mol-1
②2CH3OH(g)?CH3OCH3 (g)+H2O(g)△H2=-24.5kJ•mol-1
结合盖斯定律可知,①×2+②得到2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g),以此来解答.
解答 解:由①CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H1=-49.1kJ•mol-1
②2CH3OH(g)?CH3OCH3 (g)+H2O(g)△H2=-24.5kJ•mol-1
结合盖斯定律可知,①×2+②得到2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g),则△H=(-49.1kJ•mol-1)×2+(-24.5kJ•mol-1)=-122.7 kJ•mol-1,即热化学方程式为2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)△H=-122.7 kJ•mol-1,
故答案为:2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)△H=-122.7 kJ•mol-.
点评 本题考查热化学方程式的书写,为高频考点,把握物质的量与热量的关系、焓变为解答的关键,侧重分析与应用能力的考查,注意盖斯定律的应用,题目难度不大.


科目:高中化学 来源: 题型:解答题
 图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图.
图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠在空气和氯气中燃烧,火焰皆呈黄色,但生成固体颜色不同 | |
| B. | 新制饱和氯水和浓硝酸光照下均会有气体产生,其成分中都有氧气 | |
| C. | 浓硫酸具有较强酸性,能使Cu转化为Cu2+ | |
| D. | 灼烧NaOH固体时不能使用瓷坩埚,因为坩埚中的SiO2能与NaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.4 g镁在空气中完全燃烧生成MgO和Mg3N2,转移的电子数为0.8 NA | |
| B. | 标准状况下,5.6 L二氧化碳气体中含有的氧原子数为0.5 NA | |
| C. | 8.7 g MnO2与40 mL 10 mol/L的浓盐酸充分反应,生成的氯气分子数为0.1 NA | |
| D. | 0.1 L 0.5 mol/L CH3COOH溶液中含有的氢离子数为0.05 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
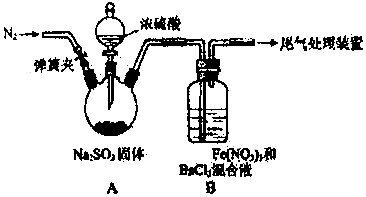
| 实验步骤 | 预期的现象和结论 |
| ①测定B中实验所用混合溶液的 ②配制具有相同pH的稀硝酸与 BaCl2的混合液并通入适当的N2 ③将SO2通入上述溶液中 | 若出现白色沉淀则假设2成立 若不出现白色沉淀则假设2不成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
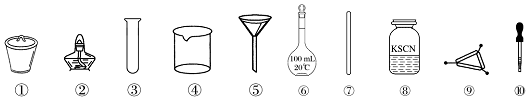
| A. | 第一步需选用仪器①、②和⑨,仪器①的名称叫坩埚 | |
| B. | 第二步用浓硝酸溶解茶叶灰,可能将Fe2+氧化成Fe3+ | |
| C. | 要完成第三步,需选用④、⑤和⑦,除夹持仪器外还缺滤纸 | |
| D. | 第四步,用试剂⑧检验滤液中的Fe3+,溶液中生成血红色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 强电解质都易溶于水,所以BaSO4是弱电解质 | |
| B. | 氨气的水溶液可以导电,但氨气属于非电解质 | |
| C. | 使用催化剂可以让不自发的化学反应自发进行 | |
| D. | 电解质溶液的导电过程属于物理变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com