
 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
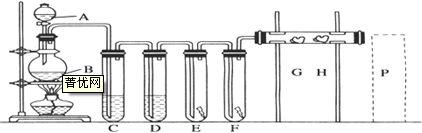
| A、澄清透明的溶液中:Cu2+、K+、SO42-、S2- |
| B、加入苯酚显紫色的溶液:K+、NH4+、Cl-、SCN- |
| C、1.0 mol?L-1的KNO3溶液中:Na+、Fe2+、Cl-、SO42- |
| D、能溶解Al2O3的溶液中:Mg2+、Fe3+、AlO2-、HCO3- |
查看答案和解析>>
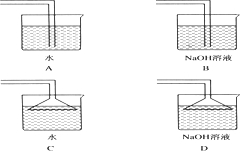
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 电解质 | 平衡方程式 | 平衡常数K | Ksp |
| CH3COOH | CH3COOH?CH3COO-+H+ | 1.76×10-5 | |
| H2CO3 | H2CO3???H++HCO3- HCO3-???H++CO32- | K1=4.31×10-4 K2=5.61×10-11 | |
| C6H5OH | C6H5OH???C6H5O-+H+ | 1.1×10-10 | |
| H3PO4 | H3PO4???H++H2PO4- H2PO4-???H++HPO42- HPO42-???H++PO43- | K1=7.52×10-3 K2=6.23×10-8 K3=2.20×10-13 | |
| NH3?H2O | NH3?H2O???NH4++OH- | 1.76×10-5 | |
| BaSO4 | BaSO4??Ba2++SO42- | 1.07×10-10 | |
| BaCO3 | BaCO3???Ba2++CO32- | 2.58×10-9 |
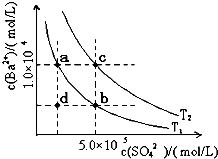 回答下列问题:
回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
A、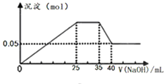 表示向含Mg2+、Al3+、NH4+的盐溶液中滴加NaOH溶液时,沉淀的量与NaOH的体积的关系图.则三种离子的物质的量之比为:n(Mg2+):n(Al3+):n( NH4+)=2:1:2,其中使用的NaOH的浓度为2mol?L-1. |
B、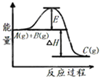 中曲线表示某反应过程的能量变化,当物质A(g)与B(g)反应生成物质C(g)时,△H>0,若使用正催化剂,E值会减小. |
C、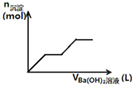 可用来表示向盐酸酸化的MgSO4溶液中加入Ba(OH)2溶液时,产生沉淀的物质的量(n)与加入Ba(OH)2溶液体积(V)之间的关系图 |
D、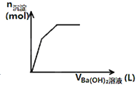 表示向一定质量的明矾溶液中滴加Ba(OH)2溶液时,产生沉淀的物质的量(n)与加入Ba(OH)2溶液体积(V)之间的关系图 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com