
【题目】氯化硫(S2Cl2)是一种黄红色液体,有刺激性、窒息性恶臭,熔点为﹣80℃,沸点137.1℃.在空气中强烈发烟,易与水发生反应.人们使用它作橡胶硫化剂使橡胶硫化,改变生橡胶受热发粘遇冷变硬的不良性能.在熔融的硫中通入氯气即可生成S2Cl2 . 下图是实验室用S和Cl2制备S2Cl2的装置(夹持装置、加热装置均已略去). 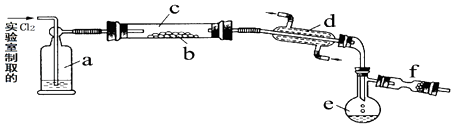
(1)已知S2Cl2分子结构与H2O2相似,请写出S2Cl2的电子式 .
(2)装置a中应放试剂为 , 其作用为 .
(3)该实验的操作顺序应为:②﹣(用序号表示). ①加热装置c ②通入Cl2③通冷凝水 ④停止通Cl2⑤停止加热装置c
(4)f装置中应放置的试剂为 , 其作用为 .
(5)已知S2Cl2与H2O反应时,只有一种元素的化合价发生了变化,且被氧化和被还原的该元素的物质的量之比为1:3,请写出该反应的化学方程式 .
【答案】
(1)![]()
(2)浓H2SO4;干燥Cl2
(3)③①⑤④
(4)碱石灰;吸收Cl2尾气,并防止空气中的水汽使S2Cl2水解
(5)2S2Cl2+2H2O=SO2+3S+4HCl
【解析】解:(1)S2Cl2分子结构与H2O2相似,S2Cl2分子中氯原子与硫原子之间形成1对共用电子对,硫原子与硫原子之间形成1对共用电子对,S2Cl2电子式为: ![]() ;所以答案是:
;所以答案是: ![]() ;(2)由信息可知S2Cl2遇水水解,进入b中的气体应该干燥.用浓硫酸干燥,a中应放试剂为浓硫酸,其作用为干燥氯气;所以答案是:浓H2SO4;干燥Cl2;(3)加热之前先通冷凝水,否则开始生成的S2Cl2不能冷却液化,最后先停止加热后停止通氯气,平衡容器内压强,防止发生危险.所以实验操作顺序为②③①⑤④;所以答案是:③①⑤④;(4)F装置盛放碱石灰,吸收Cl2尾气,防止污染环境,防止空气中的水汽加入e中使S2Cl2水解;所以答案是:碱石灰;吸收Cl2尾气,并防止空气中的水汽使S2Cl2水解;(5)只有硫元素化合价发生变化,反应中硫元素从+1价部分变为+4价,得氧化产物为SO2 , 部分变为0价,得还原产物为S,且被氧化和被还原的物质的量之比为1:3,化学方程式:2S2Cl2+2H2O=SO2↑+3S↓+4HCl; 所以答案是:2S2Cl2+2H2O=SO2+3S+4HCl.
;(2)由信息可知S2Cl2遇水水解,进入b中的气体应该干燥.用浓硫酸干燥,a中应放试剂为浓硫酸,其作用为干燥氯气;所以答案是:浓H2SO4;干燥Cl2;(3)加热之前先通冷凝水,否则开始生成的S2Cl2不能冷却液化,最后先停止加热后停止通氯气,平衡容器内压强,防止发生危险.所以实验操作顺序为②③①⑤④;所以答案是:③①⑤④;(4)F装置盛放碱石灰,吸收Cl2尾气,防止污染环境,防止空气中的水汽加入e中使S2Cl2水解;所以答案是:碱石灰;吸收Cl2尾气,并防止空气中的水汽使S2Cl2水解;(5)只有硫元素化合价发生变化,反应中硫元素从+1价部分变为+4价,得氧化产物为SO2 , 部分变为0价,得还原产物为S,且被氧化和被还原的物质的量之比为1:3,化学方程式:2S2Cl2+2H2O=SO2↑+3S↓+4HCl; 所以答案是:2S2Cl2+2H2O=SO2+3S+4HCl.


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案科目:高中化学 来源: 题型:
【题目】双氧水(H2O2)和水都是极弱的电解质,但H2O2 溶液显弱酸性。把H2O2 看成二元弱酸,则下列化学方程式不正确的是
A. H2O2 在水中电离的离子方程式:H2O2![]() H++HO2-
H++HO2-
B. 少量Na2O2与稀盐酸反应的离子方程式:O22-+2H+==H2O2
C. H2O2 稀溶液与Ba(OH)2稀溶被反应生成正盐的化学方程式:H2O2 +Ba(OH)2=BaO2+2H2O
D. H2O2 稀溶液与Ba(OH)2 稀溶液反应生成酸式盐的化学方程:2H2O2 +Ba(OH)2=Ba(HO2)2+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前工业上合成氨的反应原理为:N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-92.4 KJ/mol
2NH3(g) ΔH=-92.4 KJ/mol
(1)在恒温恒容条件下,向反应平衡体系中充入氮气,达到新平衡时,c(H2)将______(填“增大”、“减小”、“不变”或“无法判断”,下同),c(N2)·c(H2)将_______。
(2)下图为合成氨反应在不同温度和压强、使用相同催化剂条件下,初始时氮气、氢气的体积比为1:3时,平衡混合物中氨的体积分数。若分别用VA(NH3)和VB(NH3)表示从反应开始至达平衡状态A、B时的化学反应速率,则VA(NH3)_____VB(NH3)(填“>、“<”或“=")
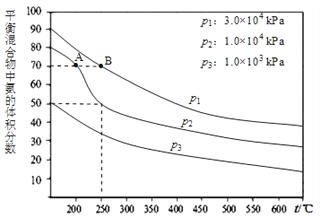
(3)①若恒温恒压下,在一容积可变的容器中,达到平衡状态时,N2、H2、NH3各1mol,若此时再充入3molN2,则平衡____移动(“向正向“向逆向”“不”);
②若氮气与氢气以1:1混合反应时,达到平衡后,如果升高温度氮气的体积分数将____(“变大”“变小”不变”下同);如果增大压强氮气的体积分数将___。
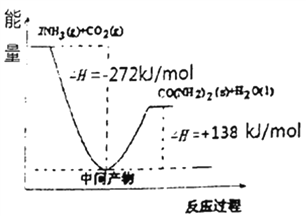
(4)H2NCOONH4是工业合成尿素的中间产物,该反应的能量变化如图所示:用CO2和氨合成尿素的热化学方程式为________。
(5)工业生产中逸出的氨可用稀硫酸吸收。若恰好生成NH4HSO4,该溶液中各离子的物质的量浓度由大到小的顺序是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W四种主族元素,它们在周期表中位置如图所示,下列说法正确的是
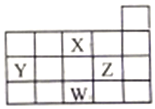
A. X、Y、Z三种元素的原子半径依次增大 B. X元素的氢化物稳定性比Y元素的弱
C. 化合物YZ4和氨气反应可以生成Y单项 D. 氢化物沸点: W>X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阅读表短周期主族元素的相关信息:
元素代号 | 相关信息 |
A | A的单质能与冷水剧烈反应,得到强碱性溶液 |
B | B的原子最外层电子数是其内层电子数的三倍 |
C | 在第3周期元素中,C的简单离子半径简单最小 |
D | A、B、D组成的36电子的化合物X是家用消毒剂的主要成分 |
E | 所有有机物中都含有E元素 |
请回答:
(1)写出E在元素周期表中的位置:;C的简单离子的结构示意图: .
(2)X的化学式为 .
(3)A,B,C三种元素的简单离子的半径由大到小的顺序为(用离子符号表示).
(4)A,B两元素组成的化合物A2B2属于(填“离子”或“共价”化合物).
(5)C元素形成的单质能与A的最高价氧化物对应的水化物反应,其离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.十氢萘是具有高储氢密度的氢能载体,经历“十氢萘(C10H18)→四氢萘(C10H12)→萘(C10H8)”的脱氢过程释放氢气。已知:
C10H18(l)![]() C10H12(l)+3H2(g) △H1
C10H12(l)+3H2(g) △H1
C10H12(l)![]() C10H8(l)+2H2(g) △H2
C10H8(l)+2H2(g) △H2
△H1>△H2>0;C10H18→C10H12的活化能为Ea1,C10H12→C10H8的活化能为Ea2,十氢萘的常压沸点为192℃;在192℃,液态十氢萘的脱氢反应的平衡转化率约为9%。请回答:
(1)有利于提高上述反应平衡转化率的条件是_________。
A.高温高压 B.低温低压 C.高温低压 D.低温高压
(2)研究表明,将适量的十萘奈置于恒容密闭反应器中,升高温度带来高压,该条件下也可显著释氢,理由是______________________________________________________。
(3)温度335℃,在恒容密闭反应器中进行高压液态十氢萘(1.00 mol)催化脱氢实验,测得C10H12和C10H8的产率x1和x2(以物质的量分数计)随时间变化关系,如图1所示。


①在8 h时,反应体系内氢气的量为__________mol(忽略其他副反应)。
②x1显著低于x2的原因是________________________________________。
③在图2中绘制“C10H18→C10H12→C10H8”的“能量~反应过程”示意图。
Ⅱ.科学家发现,以H2O和N2为原料,熔融NaOH-KOH为电解质,纳米Fe2O3作催化剂,在250℃和常压下可实现电化学合成氨。阴极区发生的变化可视为按两步进行,请补充完整。
(4)电极反应式:________________________________和2Fe+3H2O+N2=Fe2O3+2NH3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究温度对酶活性的影响,某生物兴趣小组设计了如下实验方案。
①取6支试管,分别向其中加入4mL淀粉溶液;
②将试管分别放入0℃、20℃、40℃、60℃、80℃、100℃的恒温水浴锅中保温5min;
③向装有淀粉溶液的试管中滴加2滴淀粉酶溶液,立即放回水浴锅中并计时;
④每隔1分钟取2滴左右淀粉溶液,滴于多孔反应板上,滴加1滴碘液检测。记录取出的样液遇碘不呈蓝色所需的时间t。
分析回答下列问题:
(1)该实验的自变量是________________________________。
(2)不能选择过氧化氢酶和过氧化氢溶液进行探究,是因为_____________________________。
(3)该方案中淀粉酶溶液滴加2滴,不能过多,主要是为了避免___________________________。
(4)记录的实验结果如下表(“—”表示没有记录到实验结果):
温度 | 0℃ | 20℃ | 40℃ | 60℃ | 80℃ | 100℃ |
平均时间t | — | 7min | 3min | 2min | 7min | — |
请根据表中信息,用柱形图的形式表示温度对该酶活性的影响。___________________________。

实验结果表明该淀粉酶的最适温度范围是_______________。为进一步确定最适温度,需要________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com