
【题目】POC13是重要的化工原料,某兴趣小组准备用三氯化磷、氯气、二氧化硫制备POC13,产物中还有一种遇水强烈水解的物质SOC12。

已知:PC13熔点-93.6℃、沸点76.1℃,遇水强烈水解,易与氧气反应;POC13遇水强烈水解,能溶于PC13.
(1)仪器甲的名称是________________。
(2)已知装置B制备POC13,以上仪器接口连接的顺序为a____d,装置B中发生反应的化学方程式为_________________________。
(3)B中反应温度控制在60~65℃,其原因是__________________________。
(4)用佛尔哈德法测定POC13含量:准确称取20.20g POC13产品,置于盛有60.00mL蒸馏水的水解瓶中摇动至完全水解;将水解液配成100.00mL溶液,取10.00mL溶液于锥形瓶中;加入10.00mL 3.200mol·L-1AgNO3标准溶液,并加入少许硝基苯用力摇动,使沉淀表面被有机物覆盖;加入指示剂,用0.2000mol·L-1KSCN溶液滴定过量的AgNO3溶液,达到滴定终点时共用去10.00mL KSCN溶液。
(已知:KSP(AgC1)=3.2×10-10,KSP(AgSCN)=2×10-12)
①POC13水解的化学反应方程式为______________________________。
②滴定选用的指示剂是__________(选填字母),滴定终点的现象为__________。
a.FeC12 b.NH4Fe(SO4)2 c.淀粉 d.甲基橙
③用硝基苯覆盖沉淀的目的是___________________________________。
④产品中POC13的百分含量为____________。
【答案】球形冷凝管 jiefbcgh PCl3+Cl2+SO2![]() POCl3+SOCl2 温度太高,PCl3、SO2会大量挥发,导致产量降低;温度太低,反应速率会变慢 POC13+3H2O=H3PO4+3HCl b 当最后一滴标准KSCN溶液滴入时,溶液变为红色,且半分钟不褪去 防止在滴加KSCN时将AgCl沉淀转化为AgSCN沉淀 75.99%或76%
POCl3+SOCl2 温度太高,PCl3、SO2会大量挥发,导致产量降低;温度太低,反应速率会变慢 POC13+3H2O=H3PO4+3HCl b 当最后一滴标准KSCN溶液滴入时,溶液变为红色,且半分钟不褪去 防止在滴加KSCN时将AgCl沉淀转化为AgSCN沉淀 75.99%或76%
【解析】
本题以POC13的制备为载体,考查Cl2、SO2的实验室制备、实验条件的控制,返滴定法测定POC13的含量。由于PC13、POC13、SOCl2遇水强烈水解,所以用干燥得Cl2、SO2与PC13反应制备POC13,则装置ABCDEF的主要作用依次是制备Cl2、制备POC13、制备SO2、干燥Cl2、、干燥SO2、除Cl2中的HCl气体,据此答题。
(1)根据仪器的结构和性能可知仪器甲的名称为球形冷凝管,故答案为:球形冷凝管。
(2)装置A制得的氯气中混有挥发的HCl和水蒸气,需要经过F装置内的饱和食盐水除去HCl、再利用D装置内的浓硫酸干燥,然后才可通入装置B中,装置C中制得的SO2,需要通过E中P2O5或硅胶干燥后再通入装置B中制备POCl3,则以上仪器接口连接的顺序为a→j→i→e→f→b—c←g←h←d,装置B中生成POCl时发生反应的化学方程式为PCl3+Cl2+SO2![]() POCl3+SOCl2,
POCl3+SOCl2,
故答案为:jiefbcgh,PCl3+Cl2+SO2![]() POCl3+SOCl2。
POCl3+SOCl2。
(3)B中反应温度控制在60~65℃,其原因是:温度太低,反应速率会太慢;温度太高,PCl3、SO2会大量挥发(PCl3的沸点为76.1℃),从而导致产量降低。
故答案为:温度太高,PCl3、SO2会大量挥发,导致产量降低;温度太低,反应速率会变慢。
(4)①POC13水解生成磷酸和氯化氢,水解的反应方程式为POC13+3H2O=H3PO4+3HCl,
故答案为:POC13+3H2O=H3PO4+3HCl。
②以Fe3+为指示剂,当KSCN将过量的Ag+完全沉淀时,在滴入一滴KSCN溶液与Fe3+作用,溶液变红色,所以滴定选用的指示剂是NH4Fe(SO4)2,滴定终点的现象为:当最后一滴标准KSCN溶液滴入时,溶液变为红色,且半分钟不褪去,
故答案为:b,当最后一滴标准KSCN溶液滴入时,溶液变为红色,且半分钟不褪去。
③硝基苯是难溶于水且密度大于水的液体,用硝基苯覆盖沉淀的目的是:使生成的沉淀与溶液隔离,避免滴定过程中SCN-与AgCl沉淀反应转化为AgSCN沉淀,
故答案为:防止在滴加KSCN时将AgCl沉淀转化为AgSCN沉淀。
④n(AgNO3)过量=n(KSCN)=0.2000mol·L-1×0.01L=0.002mol,沉淀10.00mL溶液中的Cl-消耗的AgNO3物质的量为3.200mol·L-1×0.01L-0.002mol=0.03mol,根据Ag++Cl-=AgCl↓和Cl-守恒,样品中n(POC13)=0.03mol/3×100.00mL/10.00mL=0.1mol,m(POC13)=0.1mol×153.5g/mol=15.35g,产品中POC13的百分含量为15.35g/20.20g×100%=75.99%,
故答案为:75.99%或76%。


 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:
【题目】氮肥是最重要的化肥,它能使农作物枝叶茂盛,叶片增大,促进叶绿素的形成,从而有利于光合作用,提高农作物产量和质量。
(1)氮气分子的电子式是_________,氨气分子的空间形状为:__________。
(2)农谚有“雷雨发庄稼”一说。用化学方程式表示在闪电作用下游离态氮转化为化合态氮的过程_____.
(3)合成氨工业是氮肥的最主要来源。写出工业合成氨的化学方程式 _________________.
(4)合成氨工业也是硝酸工业的基础,写出氨催化氧化的化学方程式_____________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里用乙醇和浓硫酸反应制取乙烯,接着再用溴与之反应生成1,2—二溴乙烷。在制备过程中由于部分乙醇被浓硫酸氧化还会生成CO2、SO2,进而与Br2反应生成HBr等。
(1)以上述三种物质为原料,用下列仪器(短接口或橡皮管均已略去)制备1,2-二溴乙烷。
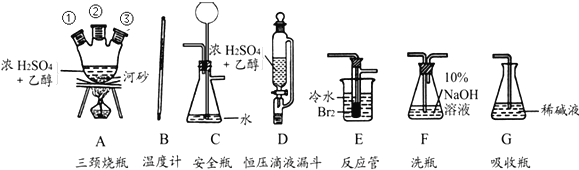
如果气体流向为从左到右,正确的连接顺序是:B经A①插入A中,D接A②;A③接______接_______接______接______。
(2)温度计水银球的正确位置是______。
(3)F的作用是______,G的作用是______。
(4)在三颈烧瓶A中的主要反应的化学方程式为______。
(5)在反应管E中进行的主要反应的化学方程式为______。
(6)反应管E中加入少量水及把反应管E置于盛有冷水的小烧杯中是因为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)溶质的质量分数为14%的KOH溶液,经加热蒸发去100g水后,质量分数变成28%,体积为80mL,则此时溶液的物质的量浓度为
A. 5mol/L B. 6mol/L C. 6.25mol/L D. 6.75mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取一张用饱和的NaCl溶液浸湿的pH试纸,两根铅笔芯作电极,接通直流电源,一段时间后,发现a电极与试纸接触处出现一个双色同心圆,内圈为白色,外圈呈浅红色。则下列说法错误的是( )

A. b电极是阴极B. a电极与电源的正极相连
C. 电解过程中水是氧化剂D. b电极附近溶液的pH变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,同体积的氨气(![]() )和硫化氢气体(
)和硫化氢气体(![]() )的质量比为_________;同质量的氨和硫化氢气体的体积比为___________;若二者氢原子数相等,则它们的体积比为___________。(均为前者比后者)
)的质量比为_________;同质量的氨和硫化氢气体的体积比为___________;若二者氢原子数相等,则它们的体积比为___________。(均为前者比后者)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是利用一种微生物将废水中的有机物(如淀粉)和废气NO的化学能直接转化为电能,下列说法中一定正确的是

A. 质子透过阳离子交换膜由右向左移动
B. 电子流动方向为N→Y→X→M
C. M电极反应式:(C6H10O5)n+7nH2O-24ne-===6nCO2↑+24nH+
D. 当M电极微生物将废水中16.2 g淀粉转化掉时,N电极产生134.4 L N2(标况下)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.糖类和油脂都是高分子化合物
B.蔗糖和麦芽糖互为同分异构体
C.葡萄糖和果糖互为同系物
D.纤维素可以被人体吸收,并释放能量供人体生命活动需要
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com