
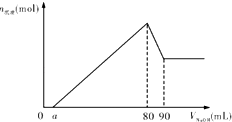
 将一块镁铝的合金投入1mo1•L-1的一定体积的稀盐酸中,待合金完全溶解后,往溶液里滴入1mo1•L-1的NaOH溶液,生成沉淀物质的量与加入NaOH溶液体积(单位mL)的关系如图.下列说法中不正确的是( )
将一块镁铝的合金投入1mo1•L-1的一定体积的稀盐酸中,待合金完全溶解后,往溶液里滴入1mo1•L-1的NaOH溶液,生成沉淀物质的量与加入NaOH溶液体积(单位mL)的关系如图.下列说法中不正确的是( )| A. | 由图可以确定该镁铝合金中铝的质量为0.27g | |
| B. | 当滴入1mo1•L-1的NaOH溶液85mL时,所得沉淀为Mg(OH)2和Al(OH)3 | |
| C. | 由图可以确定a的取值范围为:0≤a≤50 | |
| D. | 由图可以确定该合金中镁铝物质的量之比0<$\frac{n(Mg)}{n(AI)}$<2.5 |
分析 由图可知,0~amL首先发生的反应是中和过量的酸:H++OH-=H2O,amL~8mL是沉淀两种金属离子:Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓,80mL~90mL是Al(OH)3的溶解:Al(OH)3+OH-=[Al(OH)4]-,
A.根据n=cV计算n(NaOH),根据方程式计算n[Al(OH)3],根据铝原子守恒结合m=nM计算Al的质量;
B.NaOH溶液85mL时,Al(OH)3部分溶解;
C.当a=0时,沉淀中Mg(OH)2物质的量最大,进而合金中金属镁的最大量,据此计算该合金中两元素物质的量之比的最大值;
D.采用极限假设法,当金属全部是金属铝时剩余的酸最多,a的值最大来判断a得取值范围.
解答 解:由图可知,0~amL首先发生的反应是中和过量的酸:H++OH-=H2O,amL~8mL是沉淀两种金属离子:Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓,80mL~90mL是Al(OH)3的溶解:Al(OH)3+OH-=[Al(OH)4]-,
A.从横坐标80mL到90mL这段,消耗n(NaOH)=0.01L×1mol/L=0.01mol,由Al(OH)3+OH-=[Al(OH)4]-可知n(Al(OH)3)=0.01mol,再根据Al原子守恒得n(Al)=n(Al(OH)3)=0.01mol,故m(Al)=0.01mol×27g/mol=0.27g,故A正确;
B.加入NaOH溶液85mL时,只有5mL用于氢氧化铝的溶解,由图可知氢氧化铝完全溶解需要10mLNaOH溶液,故Al(OH)3部分溶解,故所得沉淀的成分为Mg(OH)2和Al(OH)3,故B正确;
C.假设盐酸溶解金属后不剩,酸恰好与合金反应完全,即a=0,通过极值法,当合金中完全是铝时,剩余盐酸最大,a值最大,沉淀0.01molAl3+需要NaOH溶液的体积为30mL,从图可知,中和过量的酸所消耗的碱液体积最大为50mL,由于金属为混合物,所以的取值范围为 0≤a<50,故C错误;
D.当a=0时,沉淀中Mg(OH)2物质的量最大,沉淀最大时消耗n(NaOH)=0.08L×1mol/L=0.08mol,故根据氢氧根守恒,Mg(OH)2物质的量最大值=$\frac{0.08mol-0.01mol×3}{2}$=0.025mol,即合金中Mg的最大物质的量为0.025mol,故该合金中镁铝物质的量之比$\frac{n(Mg)}{n(Al)}$的最大值为$\frac{0.025mol}{0.01mol}$=2.5,故0<$\frac{n(Mg)}{n(AI)}$<2.5,故D正确;
故选C.
点评 本题以图象形式考查了镁铝的性质、混合物反应的计算等知识,题目难度中等,明确图象中各个阶段发生的反应是解本题关键,明确极值法在化学计算中的应用.


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
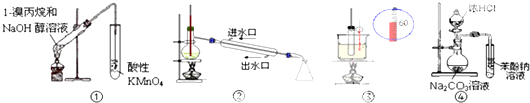
| A. | ①装置用于检验1-溴丙烷消去产物 | B. | ②装置用于石油的分馏 | ||
| C. | ④装置可证明酸性:盐酸>碳酸>苯酚 | D. | ③装置用于实验室制硝基苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑤ | B. | ①③④ | C. | ②④⑥ | D. | ⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镁条作负极,电极反应:Mg-2e-=Mg2+ | |
| B. | 铝片作负极,电极反应:Al+4OH--3e--=[Al(OH)4]- | |
| C. | 电流从Al电极沿导线流向Mg电极 | |
| D. | 铝片上有气泡产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
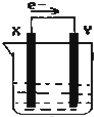 如图,在盛有稀硫酸的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,下列 关于该装置的说法正确的是( )
如图,在盛有稀硫酸的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,下列 关于该装置的说法正确的是( )| A. | 外电路电流方向为:X→外电路→Y | |
| B. | 若两极分别为铁棒和碳棒,则X为碳棒,Y为铁棒 | |
| C. | X极上发生的是还原反应,Y极上发生的是氧化反应 | |
| D. | 若两极都是金属,则它们的活动顺序为X>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com