
【化学与技术】
工业上以氨气为原料制备硝酸的过程如图1所示:
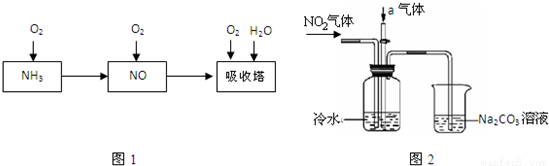
某课外小组模拟上述部分过程设计了如图2所示实验装置制备硝酸(所有橡胶制品均已被保护)
(1)工业上用氨气制取NO的化学方程式是 ;
(2)连接好装置后,首先进行的操作是 ;
(3)通入a气体的目的是 ;
(4)盛有Na2CO3溶液的烧杯为尾气处理装置,该装置中发生反应的化学方程式是 。
(5)已知:温度低于21.15℃时,NO2几乎全部转变为N2O4,工业上可用N2O4与水反应来提高硝酸产率,N2O4与a气体在冷水中生成硝酸的化学方程式是 ;
(6)一定条件下,某密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.500mol/L,c(N2O4)=0.125mol/L.则2NO2(g) N2O4(g)的平衡常数K= ,若NO2起始浓度为2mol/L,相同条件下,NO2的最大转化率为 。
N2O4(g)的平衡常数K= ,若NO2起始浓度为2mol/L,相同条件下,NO2的最大转化率为 。
(1)4NH3+5O2 4NO+6H2O
4NO+6H2O
(2)检验装置的气密性
(3)提高NO2的转化率
(4)2NO2+Na2CO3═NaNO2+NaNO3+CO2
(4)2N2O4+O2+2H2O=4HNO3
(6)1/2 50%
【解析】(1)氨气的催化氧化反应方程式为:4NH3+5O2 4NO+6H2O
4NO+6H2O
(2)连接好装置后先要检验装置的气密性,当装置气密性良好才能进一步进行实验。
(3)二氧化氮通入水中会生成硝酸和一氧化氮,再通氧气可以使一氧化氮转化为二氧化氮从而提高了NO2的转化率。
(4)根据元素守恒和得失电子守恒分析,2NO2和水反应生成硝酸,硝酸与碳酸钠反应生成硝酸钠和二氧化碳,其反应方程为2NO2+Na2CO3═NaNO2+NaNO3+CO2
(5)根据元素守恒和得失电子守恒分析,N2O4与水和氧气反应生成硝酸,反应方程式为:2N2O4+O2+2H2O=4HNO3
(6)根据平衡常数表达式计算,K= c(N2O4)/ c2(NO2)=1/2,设反应的NO2为xmol/L
2NO2(g) N2O4(g)
N2O4(g)
起始浓度: 2mol/L 0
反应浓度: x 1/2 x
平衡浓度: 2-x 1/2 x
 X=1 NO2的最大转化率=1/2×100%=50%
X=1 NO2的最大转化率=1/2×100%=50%


科目:高中化学 来源:2014高考名师推荐化学乙醇和乙酸(解析版) 题型:选择题
某品牌白酒中含有的塑化剂的主要成分为邻苯二甲酸二丁酯,其结构简式为
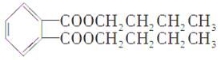
下列有关说法正确的是
A.邻苯二甲酸二丁酯的分子式为C16H21O4
B.邻苯二甲酸二丁酯属于酯类,可增加白酒的香味,对人体无害
C.用邻苯二甲酸与丁醇合成邻苯二甲酸二丁酯的反应属于取代反应
D.邻苯二甲酸二丁酯不能发生加成反应
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学Ksp的计算及有关图像的分析(解析版) 题型:填空题
已知 :难溶电解质Cu(OH)2在常温下的Ksp=2×10-20,则常温下:
(1)某CuSO4溶液里c(Cu2+)=0.02 mol·L-1,如要生成Cu(OH)2沉淀,应调整溶液的pH,使之大于________。
(2)要使0.2 mol·L-1 CuSO4溶液中的Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液里加入NaOH溶液,使溶液的pH为________。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学CB计算法(解析版) 题型:选择题
下列溶液中NO3?-的浓度与500 mL 0.4 mol·L-1 KNO3溶液中NO3-的浓度相等的是
A.50 mL 4 mol·L-1的KNO3溶液
B.1 L 0.2 mol·L-1的KNO3溶液
C.100 mL 0.2 mol·L-1的Ba(NO3)2溶液
D.500 mL 0.4 mol·L-1的Ba(NO3)2溶液
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学CB计算法(解析版) 题型:选择题
在标准状况下,将V L A气体(摩尔质量为M g·mol-1)溶于0.1 L水中,所得溶液的密度为ρ g·cm-3,则此溶液的物质的量浓度(mol·L-1)为
A. B.
B.
C.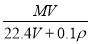 D.
D.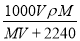
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测8 题型:选择题
已知某物质X能发生如下转化:
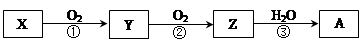
下列有关上述转化关系中物质及其反应的叙述错误的是
A若X??N2或NH3(催化氧化),则A为硝酸
B若X为S 或H2S(完全燃烧),则A为硫酸
C若X为非金属单质或非金属氢化物,则A不一定能与金属铜反应生成Y
D反应①和②一定为氧化还原反应,反应③一定为非氧化还原反应
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测8 题型:选择题
下列各组离子在指定溶液中一定能大量共存的是
A.含有Fe3+的溶液中:Na+、AlO2一、C6H5-、I-
B.含有大量NO3-的溶液中:H+、Na+、Fe3+、Cl-
C.加入Al能放出H2的溶液中:Cl-、NO3-、SO42-、K+
D.由水电离出的c(OH—)=l×10—13mol?L—1的溶液中:Na+、Ba2+、Cl-、NH4+
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测7 题型:选择题
下列说法或表述正确的是
A由水电离产生的c(H+)=1×10-2mol?L-1溶液中,可能存在:CO32-、NH4+、Cl- 、Na+
B某醋酸稀溶液的pH=a,将此溶液稀释1倍后,溶液的pH=b,则a>b
C Ba(OH)2溶液中加人过量的Al2(SO4)3溶液,其离子方程式为:3Ba2++6OH- +2Al3+ +3SO42-=3BaSO4↓+2Al(OH)3↓
D物质的量浓度均为1 mol?L-1的NaCl和MgCl2混合液中,含有Cl-的数目为3NA (NA表示阿伏加德罗常数的值)
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测5 题型:选择题
8.34gFeS04·7H20样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如下图所示
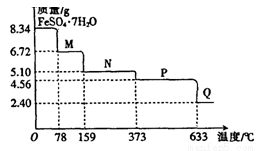
A.温度为78℃时固体物质M的化学式为FeSO4?5H2O
B.温度为l59℃时固体物质N的化学式为FeSO4?3H2O
C.在隔绝空气条件下,N得到P的化学方程式为FeSO4 FeO+SO3↑
FeO+SO3↑
D.取适量380℃时所得的样品P,隔绝空气加热至650℃,得到一种固体物质Q,同时有两种无色气体生成,Q的化学式为Fe2O3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com