
| m |
| M |
| 7.45g |
| 74.5g/mol |


 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:
| A、5.6g铁粉与足量水蒸气反应生成的H2分子数为0.10nA |
| B、1mol Mg与足量O2或N2反应生成MgO或Mg3N2失去的电子数为2nA |
| C、46g NO2 和 N2O4混合气体中含有原子数为3nA |
| D、1L 1mol?L-1醋酸溶液中离子总数为2nA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用10mL量筒量取7.1mL稀盐酸 |
| B、用广泛pH试纸测得某溶液的pH为2.3 |
| C、用25mL滴定管做中和滴定时,用去某浓度的碱溶液21.70mL |
| D、用托盘天平称量25.2g NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
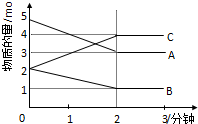 某可逆反应在某体积为5L的密闭容器中进行,在从0-3分钟各物质的量的变化情况如图所示(A、B、C均为气体).
某可逆反应在某体积为5L的密闭容器中进行,在从0-3分钟各物质的量的变化情况如图所示(A、B、C均为气体).查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 现有一定量含有氧化钠杂质的过氧化钠样品,用如图的实验装置测定过氧化钠样品的纯度.试回答下列问题:
现有一定量含有氧化钠杂质的过氧化钠样品,用如图的实验装置测定过氧化钠样品的纯度.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、构成原电池的电极材料必须是两种金属材料 |
| B、在铜、锌电极与硫酸铜溶液组成的原电池中,铜是负极 |
| C、电镀时,镀件与电源的阳极连接 |
| D、铜锌原电池工作时,若有13g锌被溶解,电路中有0.4mol电子通过 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com