
含有砒霜(As2O3)的试样和锌、盐酸混合反应,生成的砷化氢(AsH3)在热玻璃管中完全分解成单质砷和氢气。若砷的质量为1.50 mg,则( )
A.被氧化的砒霜为1.98 mg
B.分解产生的氢气为0.672 mL
C.和砒霜反应的锌为3.90 mg
D.转移的电子总数为6×10-5NA
科目:高中化学 来源: 题型:
有关烯烃的下列说法中,正确的是( )。
A.烯烃分子中所有的原子一定在同一平面上
B.烯烃在适宜的条件下只能发生加成反应不能发生取代反应
C.分子式是C4H8的烃分子中一定含有碳碳双键
D.烯烃既能使溴水褪色也能使酸性KMnO4溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
ClO2常用于水的净化,工业上可用Cl2氧化NaClO2溶液制取ClO2。写出该反应的离子方程式,并标出电子转移的方向和数目_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)____S+____KOH===____K2S+____K2SO3+____H2O
(2)____P4+____KOH+____H2O===____K3PO4+____PH3
查看答案和解析>>
科目:高中化学 来源: 题型:
取x g铜镁合金完全溶于浓硝酸中,反应过程中硝酸被还原只产生8 960 mL的NO2气体和672 mL的N2O4气体(都已折算到标准状态),在反应后的溶液中加入足量的氢氧化钠溶液,生成沉淀质量为17.02 g。则x等于( )
A.8.64 B.9.20
C.9.00 D.9.44
查看答案和解析>>
科目:高中化学 来源: 题型:
将H2S和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应回收S,其物质转化如图所示。
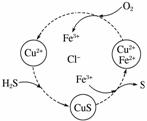
(1)在图示的转化中,化合价不变的元素是________。
(2)反应中当有1 mol H2S转化为硫单质时,保持溶液中Fe3+的物质的量不变,需消耗O2的物质的量为______。
(3)在温度一定和不补加溶液的条件下,缓慢通入混合气体,并充分搅拌。欲使生成的硫单质中不含CuS,可采取的措施有____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
用含有Al2O3、SiO2和少量FeO·xFe2O3的铝灰制备Al2(SO4)3·18H2O,工艺流程如下(部分操作和条件略):
Ⅰ.向铝灰中加入过量稀H2SO4,过滤:
Ⅱ.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色;
Ⅳ.加入MnSO4至紫红色消失,过滤;
Ⅴ.浓缩、结晶、分离,得到产品。
(1)H2SO4溶解Al2O3的离子方程式是_______________________________。
(2)将MnO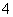 氧化Fe2+的离子方程式补充完整:
氧化Fe2+的离子方程式补充完整:
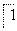 MnO
MnO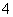 +
+ Fe2++
Fe2++ ________===
________===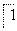 Mn2++
Mn2++ Fe3++
Fe3++ ________。
________。
(3)已知:
生成氢氧化物沉淀的pH
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
注:金属离子的起始浓度为0.1 mol·L-1
根据表中数据解释步骤Ⅱ的目的___________________________。
(4)已知:一定条件下,MnO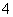 可与Mn2+反应生成MnO2。
可与Mn2+反应生成MnO2。
①向Ⅲ的沉淀中加入浓HCl并加热,能说明沉淀中存在MnO2的现象是_____________________________。
②Ⅳ中加入MnSO4的目的是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某无色溶液中含有K+、Cl-、OH-、SO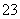 、SO
、SO ,为检验溶液中所含的某些阴离子,限用的试剂有:盐酸、硝酸、硝酸银溶液、硝酸钡溶液、溴水和酚酞溶液。检验其中OH-的实验方法省略,检验其他阴离子的过程如下图所示。
,为检验溶液中所含的某些阴离子,限用的试剂有:盐酸、硝酸、硝酸银溶液、硝酸钡溶液、溴水和酚酞溶液。检验其中OH-的实验方法省略,检验其他阴离子的过程如下图所示。

(1)图中试剂①~⑤溶质的化学式分别是
①________,②________,③________,④__________,
⑤__________。
(2)图中现象a、b、c表明检验出的离子分别是
a________、b________、c________。
(3)白色沉淀A加试剂②反应的离子方程式是_________________________。
(4)无色溶液C加试剂③的主要目的是_______________________________。
(5)白色沉淀A若加试剂③而不加试剂②,对实验的影响是____________________。
(6)气体E通入试剂④发生反应的离子方程式是______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com