
 某温度下的2L密闭容器中发生某一特定反应,3中气体起始状态和平衡状态时的物质的量(n)如下表所示,2s时达到平衡状态.回答下列问题:
某温度下的2L密闭容器中发生某一特定反应,3中气体起始状态和平衡状态时的物质的量(n)如下表所示,2s时达到平衡状态.回答下列问题:| 密闭容器 | A | B | C |
| n(起始状态)/mol | 4 | 2 | 0 |
| n(平衡状态)/mol | 2.8 | 1.4 | 1.2 |
| 密闭容器 | 甲 | 乙 | 丙 | 丁 | |
| 密闭容器体积/L | 2 | 2 | 2 | 1 | |
| 起始物质的量 | n(A)/mol | 0.4 | 0.8 | 0.8 | 0.4 |
| n(B)/mol | 0.24 | 0.24 | 0.48 | 0.24 | |
| A的平衡转化率 | 80 | α1 | α2 | α3 | |
分析 图表数据可知反应过程中变化的物质的量等于化学方程式计量数之比,A变化4mol-2.8mol=1.2mol,B变化物质的量=2mol-1.4mol=0.6mol,C物质的量变化=1.2mol,反应物质的量之比=1.2:0.6:1.2=2:1:2,化学方程式2A+B?2C,
(1)反应速率V=$\frac{△c}{△t}$计算得到A的反应速率;
(2)转化率=$\frac{消耗量}{起始量}$×100%;
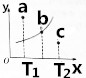
(3)①x中表示温度,y轴表示B的转化率,随温度升高B的转化率增大,说明升温平衡正向进行,正反应为吸热反应;
②C点在此温度下达到平衡状态需要y增大,B的转化率增大说明反应正向进行;
(4)①温度相同时,该反应的平衡常数不变,则甲、乙中反应的平衡常数相等,根据甲中各物质的平衡浓度计算平衡常数,平衡常数等于生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积;
②由甲、乙可知,氧气的浓度相同,二氧化硫的浓度增大会促进氧气的转化,二氧化硫转化率减小,丙和丁达到的是相同的平衡状态,丙实验氧气物质的量增大,氧气转化率增大;
③体积相同,丙中的起始浓度为甲的2倍,压强增大,平衡正向移动,则丙中转化率增大,丙和丁平衡是相同的平衡;
解答 解:图表数据可知反应过程中变化的物质的量等于化学方程式计量数之比,A变化4mol-2.8mol=1.2mol,B变化物质的量=2mol-1.4mol=0.6mol,C物质的量变化=1.2mol,反应物质的量之比=1.2:0.6:1.2=2:1:2,化学方程式2A+B?2C,
(1)图表中A起始物质的量为4mol,平衡状态物质的量为2.8mol,则消耗物质的量=4mol-2.8mol=1.2mol,A表示的反应速率V=$\frac{\frac{1.2mol}{2L}}{2s}$=0.3mol/L•s,
故答案为:0.3mol/L•s;
(2)2s时物质A的转化率=$\frac{1.2mol}{4mol}$×100%=30%,
故答案为:30%;
(3)①x中表示温度,y轴表示B的转化率,随温度升高B的转化率增大,说明升温平衡正向进行,升温向吸热反应方向进行,正反应为吸热反应,
故答案为:吸热;
②C点在此温度下达到平衡状态需要y增大,B的转化率增大说明反应正向进行,v正>v逆,
故答案为:>;
(4)①温度相同时,该反应的平衡常数不变,则甲、乙中反应的平衡常数相等,依据甲列式计算,A的转化率为80%,A反应的物质的量浓度=0.2mol/L×080%=
2A+B?2C
起始量(mol/L) 0.2 0.12 0
变化量(mol/L) 0.16 0.08 0.16
平衡量(mol/L)0.04 0.04 0.16
平衡常数K=$\frac{0.1{6}^{2}}{0.0{4}^{2}×0.04}$=400,
故答案为:400;
②由甲、乙可知,氧气的浓度相同,二氧化硫的浓度增大会促进氧气的转化,二氧化硫转化率减小,丙和丁达到的是相同的平衡状态,丙实验氧气物质的量增大,氧气转化率增大;则二氧化硫转化率,α1<α2=α3,故答案为:>;
③体积相同,丙中的起始浓度为甲的2倍,压强增大,平衡正向移动,则丙中转化率增大,即丙中c(SO3)大于甲中c(SO3)的2倍,丙体积为2L,丁体积为1L,起始量分别为0.8,0.48;0.40,24,丙和丁达到的平衡相同,三氧化硫浓度相同,丙=丁>甲,
点评 本题考查化学平衡的计算,熟悉化学平衡的三段法计算及影响平衡移动的因素即可解答,注意平衡常数只与温度有关,计算平衡常数应利用平衡浓度,题目难度较大.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:选择题
| A. | 氯水能导电,所以氯气是电解质 | |
| B. | 氯化钙溶液在电流作用下电离出Ca2+和Cl- | |
| C. | 易溶于水的化合物一定是强电解质 | |
| D. | 硝酸钠在水中的电离方程式为NaNO3═Na++NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将25gCuSO4.5H2O晶体加水配成100mL溶液,该溶液的物质的量浓度为1mol/L | |
| B. | 将100mL5mol/L盐酸溶液在蒸发皿中蒸发至50mL溶液,物质的量浓度变为10mol/L | |
| C. | 0.3mol/L的Na2SO4溶液中含有的Na+和SO42- 的总物质的量为0.9mol | |
| D. | 实验室要用容量瓶配制0.2mol/L的NaCl溶液950mL,应称量NaCl固体11.1g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅的含量居第二位,在地球上有丰富的单质硅资源,如石英、水晶、刚玉的主要成分都是SiO2 | |
| B. | 单晶硅是一种良好的半导体材料,可用于制造电缆 | |
| C. | 存放NaOH溶液的试剂瓶应用玻璃塞 | |
| D. | 硅相对于氢气便于运输、贮存,从安全角度考虑,硅是有开发价值的燃料 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cr3+ |
| 开始沉淀时的pH | 2.7 | 7.0 | 9.3 | 3.7 | - |
| 沉淀完全是的pH | 3.7 | 9.0 | 11.1 | 8 | 9(>9溶解) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、Y、W元素的原子半径依次递增 | |
| B. | X、Z、W元素的最高价氧化物的水化物的酸性依次递增 | |
| C. | X、W分别与Y形成化合物在常温下均为气态 | |
| D. | Z、W分别与Y形成的化合物均可作为耐高温材料 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com