
| A. | 水煤气反应中,生成1molH2(g)吸收131.4 kJ热量 | |
| B. | CO(g)+H2(g)?C(s)+H2O(g)△H=+131.4kJ•mol-1 | |
| C. | 水煤气反应中生成1体积CO(g)吸收131.4 kJ热量 | |
| D. | 反应物能量总和大于生成物能量总和 |
分析 A、由题干反应可知生成1mol氢气吸收的热量为131.4 KJ热量;
B、题干反应正向是吸热反应,逆向是放热反应;
C、1体积氢气物质的量不是1mol,根据热化学方程式的意义来回答;
D、吸热反应中,反应物的总能量小于生成物的总能量.
解答 解:A、由题干反应可知生成1mol氢气吸收的热量为131.4 KJ,故A正确;
B、据题干热化学方程式判断CO(g)+H2(g)=C(s)+H2O(g)△H=-131.4 kJ/mol,故B错误;
C、由题干反应可知生成1mol氢气吸收的热量为131.4 KJ,1体积氢气物质的量不是1mol,故C错误;
D、该反应是吸热反应,故反应物的总能量小于生成物的总能量,故D错误.
故选A.
点评 本题考查了反应热量变化的判断,热化学方程式的计算应用,能量守恒的分析判断,难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 完成下列各题:
完成下列各题:| 容器 | 反应速率 | 容器 | 反应速率 |
| 甲 | v(X)=3.5mol•L-1•min-1 | 乙 | v(Y)=2 mol•L-1•min-1 |
| 丙 | v(Z)=4.5mol•L-1•min-1 | 丁 | v(X)=0.075mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将蒸发皿放置在铁架台的铁圈上直接用酒精灯火焰加热 | |
| B. | 将蒸发皿放置在铁架台的铁圈上,并加垫石棉网加热 | |
| C. | 将蒸发皿放置在三脚架上直接用酒精灯火焰加热 | |
| D. | 将灼热的蒸发皿放置一段时间变凉后,放在冷水中冲洗 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
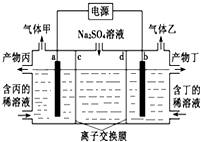 电解硫酸钠溶液生产硫酸和烧碱溶液的装置如下图所示,其中阴极和阳极均为惰性电极.测得同温同压下,气体甲与气体乙的体积比约为1:2,以下说法正确的是( )
电解硫酸钠溶液生产硫酸和烧碱溶液的装置如下图所示,其中阴极和阳极均为惰性电极.测得同温同压下,气体甲与气体乙的体积比约为1:2,以下说法正确的是( )| A. | a极与电源的负极相连 | B. | a电极反应式:2H2O+2e-=H2↑+2OH- | ||
| C. | 离子交换膜d为阴离子交换膜 | D. | 产物丙为硫酸溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com