
某酸性溶液中只有Na+、CH3COO-、H+、OH-四种离子。下列描述正确的是
A.该溶液可能由等物质的量浓度等体积的NaOH溶液和CH3COOH溶液混合而成
B.该溶液可能由PH=3的CH3COOH与pH= 11的NaOH溶液等体积混合而成
C.加入适量NaOH,溶液中离子浓度为 c(CH3COO-) >c(Na+) >c(OH-) >c(H+)
D.加入适量氨水,c(CH3COO-)—定大于c(Na+)、c(NH4+)之和
科目:高中化学 来源:2017届湖南省长沙市高三上月考四化学卷(解析版) 题型:选择题
原子结构决定元素的性质,下列说法中,正确的是
A. Na、Al、Cl的原子半径依次减小,Na+、Al3+、C1-的离子半径也依次减小
B. 在第VIA族元素的氢化物(H2R)中,热稳定性最强的其沸点也最高
C. 第2周期元素的最高正化合价都等于其原子的最外层电子数
D. 非金属元素的非金属性越强,其氧化物对应水化物的酸性也一定越强
查看答案和解析>>
科目:高中化学 来源:2016-2017学年云南省高二上期中化学卷(解析版) 题型:选择题
尿黑酸症是由酪氨酸在人体内非正常代谢而产生的一种遗传病。其转化过程如下:
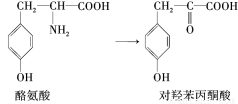
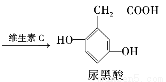
下列说法错误的是 ( )
A.酪氨酸既能与盐酸反应,又能与NaOH溶液反应
B.对羟苯丙酮酸分子中有3种含氧官能团
C.1 mol尿黑酸最多可与含3 mol NaOH的溶液反应
D.可用溴水鉴别对羟苯丙酮酸与尿黑酸
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省高二上阶段测二化学卷(解析版) 题型:实验题
浅绿色的硫酸亚铁铵晶体[又名莫尔盐,(NH4)2SO4·FeSO4·6H2O]比绿矾(FeSO4﹒7H2O)更稳定,常用于定量分析。莫尔盐的一种实验室制法如下:
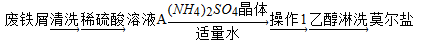
(1)向废铁屑中加入稀硫酸后,并不等铁屑完全溶解而是剩余少量时就进行过滤,其目的是________。
(2)0.10mol·L-1莫尔盐溶液中离子浓度由大到小的顺序为_________;
(3)常温下,若0.1 mol﹒L-1 (NH4)2SO4溶液的pH=5,求算NH3﹒H2O的电离平衡常数Kb=___________
(4)为了测定产品的纯度,称取ag产品溶于水,配制成500mL溶液,用浓度为c mol﹒L-1的酸性KMnO4溶液滴定。每次所取待测液体积均为25.00mL,实验结果记录如下:
实验次数. | 第一次 | 第二次 | 第三次 |
消耗高锰酸钾溶液体积/mL | .25.52, | 25.02 | 24.98 |
滴定过程中发生反应的离子方程式为:_______________。滴定终点的现象是____________________。
通过实验数据计算的该产品纯度为_________(用字母ac表)。上表中第一次实验中记录数据明显大于后两次,其原因可能是____________(填符号)。
A.实验结束时俯视刻度线读取滴定终点时酸性高锰酸钾溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
C.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
D.该酸性高锰酸钾标准液保存时间过长,有部分变质,浓度降低
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省高二上阶段测二化学卷(解析版) 题型:选择题
关于下列各图的叙述,正确的是

A.甲表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为483.6Kj·mol-1
B.乙表示恒温恒容条件下发生的可逆反应2NO2 N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
C.丙表示A、B两物质的溶解度随温度变化情况,将A、B饱和溶液分别由t1℃升温至t2℃时,溶质的质量分数B>A
D.丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则同浓度的NaA溶液的pH小于NaB溶液
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省高二上阶段测二化学卷(解析版) 题型:选择题
下列实验操作和数据记录都正确的是
A. 用25 mL碱式滴定管量取高锰酸钾溶液,体积为16.60 mL
B. 用标准NaOH溶液滴定未知浓度盐酸,用去NaOH溶液20.50mL
C. 用10 mL量筒量取8.25 mL盐酸
D. 用pH试纸测得某溶液pH为3.2
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上月考二化学试卷(解析版) 题型:选择题
一定条件下,使NO和O2在一密闭容器中进行反应2NO+O2?2NO2,下列说法中不正确的是
A.反应开始时,正反应速率最大,逆反应速率为零
B.随着反应的进行,正反应速率逐渐减小,最后为零
C.随着反应的进行,正反应速率逐渐减小,逆反应速率逐渐增大
D.随着反应的进行,逆反应速率逐渐增大,最后与正反应速率相等
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省襄阳市四校高一上学期期中化学试卷(解析版) 题型:填空题
已知铜和浓硫酸可以在加热条件下发生反应,化学方程式如下(已配平):
Cu+2H2SO4(浓) CuSO4+A↑+2H2O
CuSO4+A↑+2H2O
试通过计算和推理完成下面的问题:
(1)A物质可以与强碱反应生成盐和水,则A应该属于 (用字母代号填写)。
a.酸 b.碱 c.盐 d. 酸性氧化物 e.碱性氧化物
酸性氧化物 e.碱性氧化物
(2)该反应中被还原的元素是 (填元素名称);氧化产物是 (填化学式)
 。
。
(3)若反应消耗了3.2g Cu,则转移电子数 ,被还原的硫酸物质的量为 mol。
(4)将(2)中反应后所得到的溶液稀释后与足量BaCl2溶液反应,写出此过程发生反应的离子方程式  。
。
查看答案和解析>>
科目:高中化学 来源:2017届重庆市高三上12月考前测试化学卷(解析版) 题型:填空题
氯气在 298 K,100 kPa时,在1 L水中可溶解0.09 mol,实验测得溶于水的Cl2约有三分之一与水反应。请回答下列问题:
298 K,100 kPa时,在1 L水中可溶解0.09 mol,实验测得溶于水的Cl2约有三分之一与水反应。请回答下列问题:
(1)该反应的离子方程式为____________________;
(2)估算该反应的平衡常数____________________________(列式计算);
(3)在上述平衡体系中加入少量NaOH固体,平衡将向______________移动;
(4)如果增大氯气的压强,氯气在水中的溶解度将________________(填“增大”“减小”或“不变”),平衡将向__________________移动。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com