



 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:
| A、向某无色溶液中加入BaCl2溶液产生不溶于稀HNO3的白色沉淀,说明原溶液中一定有SO42- |
| B、向某无色溶液中加入盐酸,有无色无味的气体产生,则说明原溶液中一定有CO32- |
| C、向某溶液中滴加KSCN溶液,溶液不变红,再滴加氯水,变红,说明原溶液一定有Fe2+ |
| D、将某溶液进行焰色反应时,火焰呈黄色,则溶液中一定无K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、只有AgCl沉淀生成 |
| B、只有AgI沉淀生成 |
| C、生成等物质的量的AgCl和AgI沉淀 |
| D、两种沉淀都有,但以AgI为主 |
查看答案和解析>>
科目:高中化学 来源: 题型:
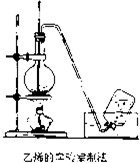 实验室制取乙烯的装置如图所示,请根据图示回答下列问题:
实验室制取乙烯的装置如图所示,请根据图示回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)可逆反应N2(g)+3H2(g)2NH3(g)是一个放热反应,有甲乙两个完全相同的容器,向甲容器中加入1molN2和3molH2在一定条件下,达到平衡时放出的热量为Q1,相同条件下,向乙容器中加入2molNH3,达到平衡时,吸收的热量为Q2,已知Q2=4Q1,则甲容器中H2的转化率为
(1)可逆反应N2(g)+3H2(g)2NH3(g)是一个放热反应,有甲乙两个完全相同的容器,向甲容器中加入1molN2和3molH2在一定条件下,达到平衡时放出的热量为Q1,相同条件下,向乙容器中加入2molNH3,达到平衡时,吸收的热量为Q2,已知Q2=4Q1,则甲容器中H2的转化率为查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液中钙离子数目减小 |
| B、溶液中钙离子浓度减少 |
| C、溶液中氢氧根离子浓度增大 |
| D、pH减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 实验目的或结论 |
| A | 向FeCl3溶液中通入Cl2,然后滴加KSCN溶液 | 验证Cl2的氧化性比Fe3+强 |
| B | 向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成 | 该溶液中不一定含有SO42- |
| C | 用洁净的Pt丝蘸取某溶液进行焰色反应,火焰呈黄色 | 该溶液中一定含有Na+,一定无K+ |
| D | 直接加热MgCl2?6H2O晶体 | 获取无水MgCl2固体 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
 | 0 | 1 | 2 | 3 |
| N2 | 1.50 | n1 | 1.20 | n3 |
| H2 | 4.50 | 4.20 | 3.60 | n4 |
| NH3 | 0 | 0.20 | n2 | 1.00 |
| A、反应进行到1小时时放出的热量为9.23kJ |
| B、反应3h内,反应速率v(N2)为0.17mol?L-1?h-1 |
| C、此温度下,该反应的平衡常数为0.037 |
| D、4h时,若再加入1molN2,达到新的平衡时,N2的转化率是原来的两倍 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com