
【题目】下图所示四种化学实验操作的名称按①②③④顺序排列分别为( )
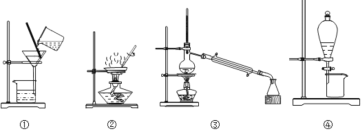
A.过滤、蒸发、蒸馏、萃取(或分液或萃取分液)
B.过滤、蒸馏、蒸发、萃取
C.蒸发、蒸馏、过滤、萃取
D.萃取、蒸馏、蒸发、过滤
 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:
【题目】最近,我国利用生产磷铵排放的废渣磷石膏制取硫酸并联产水泥的技术研究获得成功。已知磷灰石的主要成分是Ca3(PO4)2,具体生产流程如图:

回答下列问题:
(1)装置a用磷酸吸收NH3。若该过程在实验室中进行,请画出装置a的示意图:_____。
(2)热交换器是实现冷热交换的装置。化学实验中也经常利用热交换来实现某种实验目的,如气、液热交换时通常使用的仪器是_______________。
(3)依题意猜测固体A中一定含有的物质的化学式是___________(结晶水部分不写)。
(4)利用生产磷铵排放的废渣磷石膏制取硫酸,其中SO2生产硫酸的工艺流程图如图所示:

①在A处二氧化硫被氧化成三氧化硫,设备A的名称是___________,设备A中发生反应的化学方程式是______________。为提高三氧化硫的产率,该处应采用_____(填“等温过程”或“绝热过程”)为宜。
②在D处进行二次催化处理的原因是_______________________。
③B处气体混合物主要是氮气和三氧化硫.此时气体经过C后不立即进入D是因为:___________。
④20%的发烟硫酸(SO3的质量分数为20%)1吨需加水_______吨(保留2位有效数字)才能配制成98%的成品硫酸。
(5)制硫酸所产生的尾气除了含有N2、O2外,还含有SO2,微量的SO3和酸雾。能用于测定硫酸尾气中SO2含量的是___________________。
A.NaOH溶液、酚酞试液 B.KMnO4溶液、稀硫酸
C.碘水、淀粉溶液 D.氨水、酚酞试液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L的密闭容器中发生反应:4A(s)+3B(g)2C(g)+D(g),2min后B减小了1.2mol.有关此反应的说法正确的是( )
A. 在 2min 内的反应速率,用 C 表示是 0.4mol/(Lmin)
B. 分别用 B、C、D 表示化学反应速率其比值是 3:2:1
C. 达到化学反应限度时,B 物质转化率为 100%
D. 向容器中增加 A 的投量,可以加快该反应的速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物与人类生活密不可分,生活中的一些问题常涉及化学知识。
(1)有下列几种食品:

①花生油中所含人体所需的主要营养物质为___________(填“糖类”、“油脂”或“蛋白质”)。
②吃饭时,咀嚼米饭一会儿后感觉有甜味,是因为淀粉发生了_____________(填字母)反应。
A.分解 B.水解 C.裂解
(2)在日常生活中,下列做法错误的是________。
A.用燃烧法鉴别毛织品和棉织品
B.用纯碱洗涤锅盖上的油渍
C.用闻气味的方法鉴别白酒和米醋
D.用淀粉溶液鉴别加碘食盐和不含碘的食盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将2molSO2和1molO2冲入10L恒温密闭容器中,发生反应:2SO2(g)+O2(g) 2SO3(g)ΔH═-196kJ/mol,5min时达到平衡,测得反应放热166.6kJ。下列说法错误的是( )
A.0~5min内,用O2表示的平均反应速率υ(O2)═0.017mol·(L·min)-1
B.条件不变,起始时向容器中冲入4molSO2和2molO2,平衡时反应放热小于333.2kJ
C.若增大O2的浓度,则SO2的转化率增大
D.![]() 的值不变时,该反应达到平衡状态
的值不变时,该反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物的世界缤纷多彩,苯乙烯在一定条件下有如图转化关系,根据框图回答下列问题:
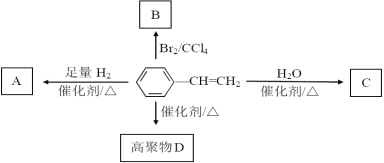
![]() 苯乙烯与
苯乙烯与![]() 的
的![]() 生成B的实验现象为______,
生成B的实验现象为______,![]() 苯乙烯最多能和含________
苯乙烯最多能和含________![]() 的
的![]() 溶液反应。
溶液反应。
![]() 苯乙烯生成高聚物D的的化学方程式为_____,该反应类型是_____。
苯乙烯生成高聚物D的的化学方程式为_____,该反应类型是_____。
![]() 苯乙烯与水反应生成C的可能生成物有________、________,其中分子中含有“
苯乙烯与水反应生成C的可能生成物有________、________,其中分子中含有“![]() ”的有机物在铜作催化剂和加热的条件下发生氧化反应的化学方程式为________。
”的有机物在铜作催化剂和加热的条件下发生氧化反应的化学方程式为________。
![]() 苯乙烯与足量
苯乙烯与足量![]() 一定条件下充分反应的生成物A的分子式为________,A的二氯代物有________种,有机物
一定条件下充分反应的生成物A的分子式为________,A的二氯代物有________种,有机物![]()
![]() 正二十烷
正二十烷![]() 存在于烤烟烟叶中,正二十烷与A的关系是________。
存在于烤烟烟叶中,正二十烷与A的关系是________。
A.同分异构体 ![]() 同系物
同系物 ![]() 同素异形体
同素异形体 ![]() 都不是
都不是
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列数量的各物质所含原子数按由大到小的顺序排列是________。
①0.5 mol氨气
②标准状况下22.4 L氦气
③4 ℃时9 mL水
④0.2 mol磷酸钠(Na3PO4)
(2)现有m g某气体,它是三原子分子,其摩尔质量为M g·mol-1。若阿伏加德罗常数用NA表示,请用以上符号及相应数字填写下列空格。
①该气体的物质的量为________mol。
②该气体所含原子总数为________个。
③该气体在标准状况下的体积为________L。
④该气体完全溶于水形成V L溶液(不考虑反应),所得溶液的物质的量浓度为________mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸镍是一种重要的化工中间体,是镍行业研究的热点。一种以石油化工中废镍催化剂(主要成分为NiCO3和SiO2,含少量Fe2O3、Cr2O3)为原料制备硫酸镍的工业流程如图:
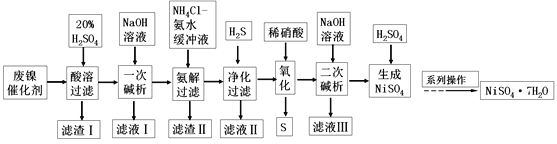
已知:①NiS、Ni(OH)2、Cr(OH)3均难溶于水,Cr(OH)3是两性氢氧化物。
②Fe(OH)3不溶于NH4Cl-氨水的混合液,Ni(OH)2溶于NH4Cl-氨水的混合液生成[Ni(NH3)6]2+。
请回答下列问题:
(1)“酸溶”时为了提高浸取率,可采取的措施有________(任写出一条)。
(2)“滤渣I”的主要成分是_________。
(3)“一次碱析”时,加入的NaOH溶液需过量,则含铬微粒发生反应的离子方程式为__________。
(4)“氨解”的目的为___,“净化”时加入的H2S的目的是将镍元素转化为____沉淀。
(5)“氧化”时发生反应的离子方程为________。
(6)“二次碱析”时,若使溶液中的Ni2+沉淀完全(离子浓度≤10-5mol·L-1时,离子沉淀完全),则需维持c(OH-)不低于_______(已知Ni(OH)2的Ksp=2×10-15,![]() ≈1.4)。
≈1.4)。
(7)以Fe、Ni为电极制取Na2FeO4的原理如图所示。通电后,在铁电极附近生成紫红色的FeO42-。电解时阳极的电极反应式为________,离子交换膜(b)为__________(填“阴”或“阳”)离子交换膜。
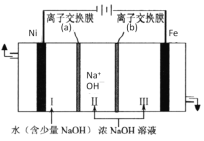
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向100 mL 0.1 mol·L-1 HA溶液中逐滴加入0.2 mol·L-1 MOH溶液,所得溶液的pH变化曲线如图所示。下列有关说法正确的是 ( )
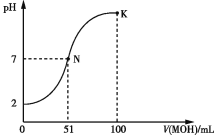
A.HA的电离方程式:HA![]() H++A-
H++A-
B.N点、K点水的电离程度:N<K
C.N点溶液中:c(A-)=c(M+)=c(H+)=c(OH-)
D.K点溶液中:c(OH-)+c(MOH)+c(A-)-c(H+)=0.1 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com