
| A. | c1:c2的值不能确定 | |
| B. | 平衡时,Y和Z的生成速率之比为1:1 | |
| C. | 0.48mol•L-1<c1+c2+c3<0.56mol•L-1 | |
| D. | c1的取值范围为0<c1<0.14 mol•L-1 |
分析 X(g)+3Y(g)?2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),到达平衡时,X、Y、Z的浓度分别为0.1mol•L-1、0.3mol•L-1、0.08mol•L-1,利用极值转化;
A、起始浓度-变化浓度=平衡浓度,X、Y的化学计量数为1:3,平衡时浓度为1:3,则起始X、Y的起始浓度为1:3;
B、Y的生成速率,表示逆反应速率,Z的生成速率表示正反应速率,不同物质表示的正逆反应速率等于化学计量数之比,可逆反应到达平衡状态;
C、该反应正反应是体积减小的反应,反应向正反应进行建立平衡,起始浓度之和最大,反应向逆反应进行建立平衡,起始浓度之和最小,结合极限法计算;
D、应向正反应进行建立平衡,X起始浓度之和最大,反应向逆反应进行建立平衡,X起始浓度之和最小,结合极限法计算.
解答 解:A、X、Y的化学计量数为1:3,所以X、Y的浓度变化之比为1:3,平衡时浓度为1:3,起始浓度=变化浓度+平衡浓度,则起始X、Y的起始浓度为(1+1):(3+3)=1:3,故A错误;
B、不同物质表示的正逆反应速率等于化学计量数之比,可逆反应到达平衡状态,Y的生成速率表示逆反应速率,Z的生成速率表示正反应速率,所以平衡是Y和Z的生成速率之比为3:2,故B错误;
C、该反应正反应是体积减小的反应,若反应向正反应进行建立平衡,起始浓度之和最大,平衡时X、Y、Z的浓度分别为0.1mol•L-1、0.3mol•L-1、0.08mol•L-1,将Z极限法转化为左边,结合X(g)+3Y(g)?2Z(g)可知,X的浓度变化为0.04mol/L、Y的浓度变化为$\frac{3}{2}$×0.08mol/L=0.12mol/L,所以c1+c2+c3<0.1mol/L+0.3mol/L+0.04mol/L+0.12mol/L=0.56mol/L;若反应向逆反应进行建立平衡,起始浓度之和最小,平衡时X、Y、Z的浓度分别为0.1mol•L-1、0.3mol•L-1、0.08mol•L-1,将X、Y极限法转化为右边,结合X(g)+3Y(g)?2Z(g)可知,Z的浓度变化为0.2mol/L,X、Y无剩余,所以c1+c2+c3>0.2mol/L+0.08mol/L=0.28mol/L,故0.28mol/L<c1+c2+c3<0.56mol/L,故C错误;
D、应向正反应进行建立平衡,X起始浓度之和最大,反应向逆反应进行建立平衡,X起始浓度之和最小,由C选项中计算可知,X的起始浓度c1的取值范围为0<c1<0.1mol/L+0.04mol/L=0.14mol•L,故D正确;
故选D.
点评 本题考查化学平衡的计算,难度中等,理解可逆反应的不完全性与平衡建立途径,注意极限法在平衡判断中的运用.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | NaAlO2溶液中通入过量的CO2:AlO2-+CO2+2H2O=Al(OH)3↓+CO32- | |
| B. | NO2溶于水:3NO2+H2O=2H+$_{\;}^+$+2NO3-+NO | |
| C. | 醋酸溶液与水垢中的Mg(OH)2反应:Mg(OH)2+2H+═Mg2++2H2O | |
| D. | NaClO溶液中通入过量的SO2:ClO-+SO2+H2O=HClO+HSO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
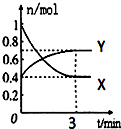 在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:2NO2(g)?N2O4(g)(无色),如图所示.
在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:2NO2(g)?N2O4(g)(无色),如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同周期元素的原子半径以ⅦA族的为最大 | |
| B. | 短周期中次外层电子数是最外层电子数2倍的原子一定是非金属元素 | |
| C. | 同主族两种元素原子的核外电子数的差值可能为26 | |
| D. | 科学家在周期表中金属元素与非金属元素分界线处找到了优良的催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不用稀硫酸,改用98%浓硫酸 | B. | 改用热的稀硫酸溶液 | ||
| C. | 滴加少量CuSO4溶液 | D. | 不用铁片,改用铁粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 共价化合物形成的分子之间均存在分子间作用力 | |
| B. | SO2和SiO2的晶体类型不相同 | |
| C. | F2、Cl2、Br2、I2的熔沸点逐渐升高,是因为分子间作用力越来越大 | |
| D. | H2O的热稳定性大于H2S,是因为水分子间存在氢键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com