
| A. | 铜全部溶解,且溶液为蓝色,有红棕色气体产生 | |
| B. | 铜部分溶解,且溶液为蓝色,有红棕色气体产生 | |
| C. | 铜全部溶解,且溶液为蓝色,有无色气体产生 | |
| D. | 铜部分溶解,且溶液为蓝色,有无色气体产生 |
分析 Cu在常温下可以和稀硝酸反应,但与硫酸不反应,Cu与稀硝酸反应的方程式:3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O,当铜有剩余,溶液中无硝酸时,溶液中的稀硫酸、硝酸铜可继续氧化单质铜,方程式为:3Cu+Cu(NO3)2+4H2SO4═4CuSO4+2NO↑+4H2O,反应实质为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,以此来解答.
解答 解:Cu在常温下可以和稀硝酸反应,但与硫酸不反应,Cu与稀硝酸反应的方程式:3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O,当铜有剩余,溶液中无硝酸时,溶液中的稀硫酸、硝酸铜可继续氧化单质铜,方程式为:3Cu+Cu(NO3)2+4H2SO4═4CuSO4+2NO↑+4H2O,反应实质为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,溶液中的氢离子物质的量为:0.2mol+0.11mol=0.31mol,硝酸根离子的物质的量为:0.11mol,单质铜的物质的量为:0.1mol,根据反应关系式:
3Cu~8H+~2NO3-,可知溶液中的氢离子、硝酸根都过量,单质铜完全溶解,生成硝酸铜溶液为蓝色,生成的NO无色,遇空气后被氧化生成红棕色的二氧化氮,故C正确,
故选C.
点评 本题考查铜及其化合物的性质,为高频考点,把握发生反应的实质及现象为解答的关键,侧重分析与实验能力的考查,注意硝酸盐在酸性条件下的性质,题目难度不大.


 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:实验题
| 物质 | CH4 | CO2 | CO | H2 |
| 体积分数 | 0.1 | 0.1 | 0.4 | 0.4 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉和油脂的水解都是高分子生成小分子的过程 | |
| B. | 2-甲基丙烷和异丁烷互为同系物 | |
| C. |  属于取代反应 属于取代反应 | |
| D. | C3H4Cl2的链状有机物的同分异构体有5种(不考虑立体异构) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 外加直流电源保护钢闸门时,钢闸门与电源的负极相连 | |
| B. | 铅蓄电池在放电过程中,负极质量增加,正极质量减少 | |
| C. | 锅炉中沉积的CaSO4可用饱和Na2CO3溶液浸泡,再将不溶物用稀盐酸溶解除去 | |
| D. | t℃时,恒容密闭容器中反应:NO2(g)+SO2(g)?NO(g)+SO3(g),通入少量O2,K值及SO2转化率不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al(OH)3是某些胃药的一种成分 | |
| B. | 乳酸铁是某些补铁口服液的有效成分 | |
| C. | 臭氧可以作为新型自来水消毒剂 | |
| D. | SO2常用作红葡萄酒中杀菌消毒剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 单甘油酯、混甘油酯、苛性钾、氢硫酸、三氧化硫 | |
| B. | 胆矾、漂白粉、硫酸钠、次氯酸、氨气 | |
| C. | 明矾、水煤气、盐酸.醋酸、铜 | |
| D. | 冰醋酸、福尔马林、硫酸钡、氢硫酸、乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1mol CO、2mol H2 | 1mol CH3OH | 2mol CH3OH |
| CH3OH的浓度(mol/L) | c1 | c2 | c3 |
| 反应的能量变化 | 放出a kJ | 吸收b kJ | 吸收c kJ |
| 平衡时体积(L) | V1 | V2 | V3 |
| 反应物转化率 | α1 | α2 | α3 |
| A. | 2c1>c3 | B. | a+b=90.7 | C. | 2V2<V3 | D. | α1+α3=0.75 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y |
| Z | W |
| A. | 若HmXOn为强酸,则X的氢化物溶于水一定显酸性(m、n均为正整数) | |
| B. | 若四种元素均为非金属,则W的最高价氧化物对应水化物一定为强酸 | |
| C. | 若四种元素中只有一种为金属,则Y的最高价氧化物对应水化物一定为强酸 | |
| D. | 若四种元素均为金属,则Z的最高价氧化物对应水化物一定为强碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
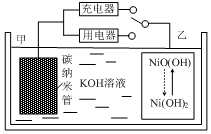 2016年8月,联合国开发计划署在中国的首个“氢经济示范城市”在江苏如皋落户.用吸附了H2的碳纳米管等材料制作的二次电池的原理如图所示.下列说法正确的是( )
2016年8月,联合国开发计划署在中国的首个“氢经济示范城市”在江苏如皋落户.用吸附了H2的碳纳米管等材料制作的二次电池的原理如图所示.下列说法正确的是( )| A. | 放电时,甲电极为正极,OH-移向乙电极 | |
| B. | 放电时,乙电极反应为:NiO(OH)+H2O+e-=Ni(OH)2+OH- | |
| C. | 充电时,电池的碳电极与直流电源的正极相连 | |
| D. | 电池总反应为H2+2NiOOH$?_{充电}^{放电}$2Ni(OH)2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com